Les Peptides

Les Peptides
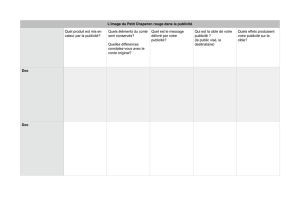
Doc 1: La création de la liaison peptidique
Doc 2: Equilibre entre les 2 formes mésomères
Doc 3: Caractéristiques de la liaison peptidique dans l'espace
• 6 atomes coplanaires
• Les C alpha sont trans/liaison C-N
• L'axe de la molécule est une ligne brisée.
• Libre rotation autour des liaisons C-C et C
alpha -N.

Doc 4: Conventions d'écriture
Par convention :
- le groupement aminé s'écrit à gauche ;
–les acides aminés sont numérotés à partir de ce même groupement.
–
Doc 5: Démarche générale pour la détermination de la structure
primaire (= séquençage)
Préparation de la protéine
pour le séquençage:
a. Déterminer le nombre de
chaînes polypeptidiques
(sous-unités) différentes de
la protéine.
b. Rompre les ponts
disulfures de la protéine.
c. Séparer et purifier les
sous-unités individuelles.
d. Déterminer la composition
en acides aminés des sous-
unités.
Séquençage des chaînes
polypeptidiques:
a. Fragmenter les sous-
unités à des endroits
spécifiques pour obtenir des
peptides suffisamment petits
pour être séquences
directement.
b. Séparer et purifier les
fragments.
c. Déterminer la séquence en
acides aminés de chaque
fragment peptidique.
d. Répéter l'étape 2(a) avec
une méthode de
fractionnement de spécificité
différente afin que la sous-
unité soit hydrolysée au
niveau de liaisons
peptidiques différentes.
Séparer ces fragments
peptidiques comme dans
2(b) et déterminer leurs
séquences en acides aminés
comme dans 2(c).
Reconstitution de la
structure complexe:
a. Recouvrir les points
d'hydrolyse d'une série de
fragments peptidiques par
l'autre série. Par
comparaison, les séquences
de ces séries de polvpeptides
peuvent être mises dans
l'ordre qui correspond à celui
de la sous-unité, ce qui
donne sa séquence en acides
aminés.
b. Déterminer la position des
ponts disulfures, s'il y en a
entre et à l'intérieur des
sous-unités.

Doc 6: Détermination de la composition en AA: nature et proportion
des AA présents
Profil obtenu après fractionnement chromatographique d'un mélange d'amino-acides sur
colonne de polystyrène sulfoné et dosage colorimétrique à la ninhydrine. L'élution est
réalisée en utilisant successivement les tampons suivants: pH 3,25 - Na+ 0,2N; pH 4,25 -
Na+0,2N; pH 5,9 - Na+ 1,4 N...
--> Hydrolyse acide totale
--> Séparation, identification et dosage par chromatographie d'échange d'ions automatisée
(colonne d'HPLC).
Doc 7: Dégradation d'Edman

Notez que la réaction se fait en trois étapes distinctes qui nécessitent chacune des
conditions tout à fait différentes. Les résidus d'acides aminés peuvent ainsi être enlevés de
l'extrémité N-terminale du polypeptide de façon séquentielle contrôlée.
Doc 8: Action des endo et exo peptidases
Doc 9: Spécificité d'action de certaines exopeptidases

Doc 10: Mode d'action des carboxypeptidases
Doc 11: Mode d'action du Bromure de Cyanogène (CNBr)
 6
6
 7
7
1
/
7
100%