Comment mieux faire avec un sarcome - Chirurgie

SOMMAIRE
CAS CLINIQUES ILLUSTRANT LE ROLE DE L’ACTE OPERATOIRE INITIAL
P.MEEUS
CLASSIFICATION SIMPLIFIEE. APPORTS DE L’ANATOMOPATHOLOGIE ET DE LA
BIOLOGIE MOLECULAIRE
JM. GUINEBRETIERE
COMMENT OPTIMISER EN PLANIFIANT ? : APPORT DES RCP A LA STRATEGIE
THERAPEUTIQUE
JL. VERHAEGHE
STANDARDS DU TRAITEMENT CHIRURGICAL D’UN SARCOME
E. STOECKLE
« COMMENT FAIS-JE ? » POUR LES SARCOMES RETRO PERITONEAUX
S. BONVALOT

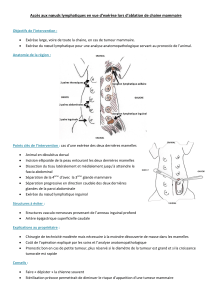
Sarcome de Membre
cas clinique
Dr P.Meeus
Service de chirurgie
Centre Léon Bérard
Lyon


Anatomopathologie
Tumeur cuisse D (lames ext. réf. 09H7687 - Dr Faysse) : sarcome à cellules
fusiformes et plémorphes de haut grade à considérer après immunophénotypage
comme un myxofibrosarcome.
Codification ADICAP : OHXIF7D0; OHXI017211

IRM à 50 jours….
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
1
/
34
100%