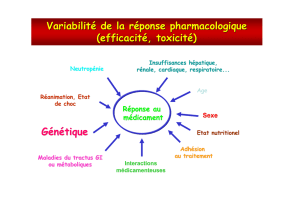
“ A La pharmacogénétique entre enfin dans la pratique médicale

“
64 | La Lettre du Pharmacologue • Vol. 27 - n° 3 - juillet-août-septembre 2013
ÉDITORIAL
La pharmacogénétique
entre enfin dans la pratique médicale
Pharmacogenetics on its way toward clinic
Pr Laurent
Becquemont
Pharmacologue médical,
faculté de médecine
et université Paris-Sud,
unité de recherche clinique
et centre de recherche clinique,
hôpital Bicêtre,
Le Kremlin-Bicêtre.
Alors que la pharmacogénétique apparaît au milieu du siècle dernier
avecladescription d’hémolyses sous antipaludéens chez les patients
déficients en G6PD, il faut attendre le e siècle pour qu’elle soit mise
àladisposition des cliniciens. Et encore, timidement, avec un accès confidentiel
limité aux centres hospitalo-universitaires, sans indications officielles
bienclaires !
Pourquoi ce retard à l’introduction de tests pharmacogénétiques
danslapratique médicale de routine ? Il existe plusieurs raisons à cela :
peudegens, finalement, connaissent la pharmacogénétique, qui n’est guère
enseignée en faculté de médecine, car seul un nombre réduit d’enseignants
maîtrise cette discipline. L’information concernant les médicaments pour lesquels
un test pharmacogénétique est utile ouindispensable n’est pas consensuelle.
Lesmodalités pratiques, en médecine ambulatoire, représentent également
unfrein : s’il faut réaliser un test pharmacogénétique avant de prescrire
unmédicament, il faut revoir le patient aveclerésultat pour décider ou non
deprescrire le médicament. Le délai pour obtenir le résultat d’un test
pharmacogénétique et savoir où adresser le patient “refroidit” souvent
leprescripteur. Enfin, l’un des arguments les plus utilisés concerne le faible
niveau de preuve des données pharmacogénétiques.
Tous ces freins sont progressivement levés : les pharmacologues,
lestoxicologues, les biochimistes, les oncologues commencent à maîtriser le sujet
et à l’enseigner, notamment dans le domaine de l’oncologie médicale. Un réseau
national pluridisciplinaire de pharmacogénétique s’est constitué depuis quelques
années pourassurer la qualité et l’accessibilité des tests, et diffuser l’information
surleurpertinence clinique(1). Cette question de la pertinence clinique est
eneffet laplus importante. Autant le niveau de preuve des données
surlapertinence des tests pharmacogénétiques au regard de l’efficacité à long
terme de certains médicaments estsouvent encore incertain, autant
desinformations purement pharmacologiques pourraient systématiquement être
transcrites dans les autorisations de mise surlemarché (AMM) ;
ainsi,quandunmédicament est éliminé par voie rénale, ilparaît évident
d’adapter sa posologie au débit de filtration glomérulaire en se basant
surunesimple étude pharmacocinétique menée sur de petits groupes de patients
ayant divers niveaux de fonction rénale. Autant, quand une même étude
pharmacocinétique indique clairement qu’en fonction du génotype d’une enzyme
hépatique les concentrations plasmatiques d’un médicament diffèrent
d’unfacteur2à30, on ne traduit pas ces données dans les AMM,
pourquoi nerecommande-t-on pas, comme dans l’insuffisance rénale,
d’adapter laposologie au génotype : est-ce par ignorance delapharmacogénétique
que les régulateurs ne tiennent pas compte decesdonnées etne les font pas
LPH-03-2013.indd 64 01/10/13 11:07

”
La Lettre du Pharmacologue • Vol. 27 - n° 3 - juillet-août-septembre 2013 | 65
ÉDITORIAL
entrer dans le libellé des AMM ? Je le crains, hélas, mais, fortheureusement,
leseffectifs se renouvellent, avec de nouvelles connaissances, etlesagences
réglementaires (en particulier la Food and Drug Administration) intègrent
deplus en plus de données pharmacogénétiques dans les AMM.
Parallèlement, l’Agence de la biomédecine reconnaît et collige l’activité
nationale depharmacogénétique(2). Elle délivre également l’agrément pour
l’examen descaractéristiques génétiques (restreintes à la pharmacogénétique)
d’une personne àdesfins médicales. Grâceau travail mené par le réseau national
de pharmacogénétique, leportail des maladies rares, Orphanet, a intégré certains
tests de pharmacogénétique pourune meilleure diffusion de l’information auprès
des patients et des prescripteurs(3).
Ces initiatives sont à l’origine d’un doublement annuel de l’activité
depharmacogénétique exercée dans le cadre du soin : 6 442analyses
pharmacogénétiques ont été pratiquées en France en2009, 11 564 en2010
et21 037 en2011. Ces chiffres necomprennent pas l’activité d’oncogénétique
(surles tumeurs), qui croît de façon quasi exponentielle.
Vous trouverez dans ce numéro quelques exemples pertinents d’application
delapharmacogénétique –tant en ce qui concerne la pharmacogénétique
constitutionnelle que l’oncogénétique (somatique)– qui, je l’espère, contribueront
à promouvoir cetteactivité, dans l’objectif de toujours mieux prescrire
lesmédicaments.
AVIS AUX LECTEURS
Les revues Edimark sont publiées en toute indépendance et sous l’unique et entière responsabilité du directeur de la publication et du rédacteur en chef.
Le comité de rédaction est composé d’une dizaine de praticiens (chercheurs, hospitaliers, universitaires et libéraux), installés partout en France, qui repré-
sentent, dans leur diversité (lieu et mode d’exercice, domaine de prédilection, âge, etc.), la pluralité de la discipline. L’équipe se réunit 2 ou 3fois par an
pour débattre des sujets et des auteurs à publier.
La qualité des textes est garantie par la sollicitation systématique d’une relecture scientifique en double aveugle, l’implication d’un service de rédaction/
révision in situ et la validation des épreuves par les auteurs et les rédacteurs en chef.
Notre publication répond aux critères d’exigence de la presse :
· accréditation par la CPPAP (Commission paritaire des publications et agences de presse) réservée aux revues sur abonnements,
· adhésion au SPEPS (Syndicat de la presse et de l’édition des professions de santé),
· indexation dans la base de données INIST-CNRS,
· déclaration publique de liens d’intérêts demandée à nos auteurs,
· identification claire et transparente des espaces publicitaires et des publirédactionnels en marge des articles scientifiques.
1. www.pharmacogenetics.fr
2. http://www.agence-biome-
decine.fr/annexes/bilan2011/
donnees/diag-post/01-gene-
tique/synthese.htm#t6
3. http://www.orpha.net
L’auteur déclare avoir des liens
d’intérêts avec les laboratoires
GSK, Roche, Sanofi et Servier.
LPH-03-2013.indd 65 01/10/13 11:07
1
/
2
100%