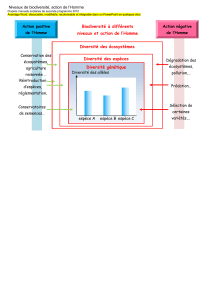
1 Les écosystèmes de la zone côtière


MASTER d’OCÉANOGRAPHIE
Spécialité :
Océanographie
Physique,
Chimique
et Biologique
OPCB 350
—
Interactions Continent / Océan / Atmosphère
BIOGÉOCHIMIE CÔTIÈRE
Cours de B. Quéguiner
Centre d'Océanologie de Marseille

ii
©Bernard Quéguiner, 2009
citation : Quéguiner B. 2009. Biogéochimie Côtière.
Centre d’Océanologie de Marseille, Aix-Marseille Université ; CNRS ; LOPB UMR
6535, Laboratoire d’Océanographie et de Biogéochimie, OSU/Centre
d’Océanologie deMarseille, 49 pp.

iii
1 Les écosystèmes de la zone côtière.............................................................................................. 1
1.1 Définition de la zone côtière ...................................................................................... 1
1.2 L’influence de l’Homme ............................................................................................ 3
1.3 La diversité menacée des écosystèmes côtiers........................................................... 3
1.4 La variabilité des écosystèmes côtiers ....................................................................... 4
1.5 Les facteurs hydrodynamiques et la structuration des écosystèmes
côtiers .........................................................................................................................6
1.5.1 Les systèmes estuariens........................................................................................ 6
1.5.2 La marée............................................................................................................... 8
1.5.3 La classification dynamique des systèmes estuariens.......................................... 9
1.6 Le rôle des apports d’eau douce............................................................................... 10
1.6.1 Echelles de variabilité et régimes des apports.................................................... 10
1.6.2 Les apports fluviaux à l'échelle globale ............................................................. 13
1.7 Les perturbations des écosystèmes côtiers............................................................... 15
1.7.1 La dystrophie des eaux côtières et ses conséquences......................................... 15
1.7.2 L’eutrophisation côtière ..................................................................................... 16
1.7.3 Régulation des cours d’eau et rétention continentale du silicium...................... 17
2 Processus de transformation de la matière dans les zones estuariennes .................................... 19
2.1 La zonation verticale des processus redox et des communautés
microbiennes au sein du sédiment............................................................................ 19
2.1.1 Les équilibres d’oxydo-réduction....................................................................... 19
Rappel sur les réactions d’oxydo-réduction ............................................................................19
L’état d’oxygénation des sédiments ........................................................................................19
2.1.2 La mesure du potentiel d’oxydo-réduction dans les sédiments.......................... 20
Définition du potentiel redox...................................................................................................21
Les problèmes de la mesure du potentiel redox.......................................................................22
2.1.3 L’interprétation de la composition chimique de l’eau interstitielle ................... 22
2.1.4 Calcul des flux diffusifs et des vitesses des réactions de diagenèse .................. 24
Système à l’équilibre (steady state) et application de la première loi de Fick ........................24
Système en conditions non stationnaires (non steady-state) et application de
la seconde loi de Fick ..............................................................................................................25
2.1.5 Zonation verticale des communautés microbiennes........................................... 26
L’activité ecto-enzymatique ....................................................................................................27
La zonation redox...................................................................................................................27
Comparaison entre les sédiments océaniques et côtiers ..........................................................28
2.2 La dynamique des blooms phytoplanctoniques en zone côtière .............................. 30
2.2.1 1° cas d’étude : la baie de San Francisco. .......................................................... 30
Les principales caractéristiques des écosystèmes côtiers peu profonds ..................................31
L’examen des échelles de variabilité.......................................................................................32

iv
Les implications sur la définition d’une stratégie d’étude des écosystèmes
côtiers ......................................................................................................................................35
Les mécanismes des blooms phytoplanctoniques en baie de San Francisco...........................36
2.2.2 2° cas d’étude : la rade de Brest ......................................................................... 40
Un exemple de modifications de l’environnement trophique.................................................. 40
Résistance d’un écosystème côtier à l’eutrophisation ............................................................. 42
La pompe à silicium dans les écosystèmes côtiers ..................................................................44
Références ........................................................................................................................................ 47
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
1
/
54
100%