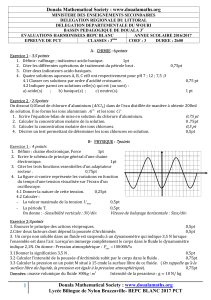
On fait subir à une mole d'eau la transformation EFGHIJE... Les volumes molaires de l'eau liquide respectivement aux

Contrôle Rattrapage – Thermodynamique 2
SMP – S3 – Durée 1h30 - 2012
Exercice 1 : Chaleur latente de vaporisation en fonction de la température (10.5pts)
On fait subir à une mole d'eau la transformation EFGHIJE (figure ci-dessous).
Les volumes molaires de l'eau liquide respectivement aux
températures
T
et
'
T
sont notés
f
V et
'
f
V De même on
note
g
V et
'
g
V les volumes molaires de la vapeur d'eau
aux températures
T
et
'
T
. On
négligera
les volumes
molaires du liquide face aux volumes molaires de la
vapeur. Les capacités calorifiques molaires
f
C et
g
C
respectivement des phases liquide et vapeur, sont
considérées comme
indépendantes
de la température.
La vapeur d'eau est
assimilée
à un gaz parfait même à l’état de saturation et
gf
CC
>
.
1.
Représenter
le cycle étudié sur le diagramme en coordonnées T-v.
2.
On appelle
L
et
'
L
les chaleurs molaires de vaporisation respectivement aux températures
T
et
'
T
. Donner
et indiquer le signe
des
travaux
échangés
EF
W
,
FG
W
,
GH
W
,
HI
W
,
IJ
W
et
JE
W
.
Donner
et indiquer le signe
des
chaleurs échangées
EF
Q
,
FG
Q
,
GH
Q
,
HI
Q
,
IJ
Q
et
JE
Q
.
3.
Utiliser le
premier principe de la thermodynamique et déterminer l'expression de la différence
'
L
L
−
en fonction de
f
C,
g
C ,
T
et
'
T
. En déduire que la chaleur latente peut s'écrire sous
la forme ATLL
0
−=
où
0
L
et
A
sont deux constantes positives à
déterminer
.
4.
Tracer l'allure de la courbe de variation de
L
en fonction de
T
.
5.
Que peut-on dire de la température à laquelle
L
=0.
Exercice 2 : Turbine
Prendre : c
p
(air) = 1000 J/kg/K, R = 8,314 J/mol/K, M
air
= 29g
(3.5pts)
De l’air (gaz parfait,
c
p
=1kJ/kg/K
) se détend dans les aubages d'une turbine. L'enthalpie massique
à l’entrée est
1
h=865,3kJ/kg et la vitesse étant
1
c=70m/s. L'enthalpie massique à la sortie est
2
h=332kJ/kg et la vitesse à la sortie est
2
c=100m/s. Le débit massique est de
s/kg10m
=
&.
1/ En supposant le processus adiabatique, calculer la puissance
t
W
&
développée par la turbine.
2/ La température d’entrée vaut
C627T
1
°=
. Calculer la température
2
T
à la sortie.
3/
Dans la réalité le processus n’est pas adiabatique et la turbine fournit une puissance
kW4620W
'
t
=
&
. Calculer la chaleur échangée
't
Q
et le rendement
s
η
de la turbine.
Exercice 3 : Transformations adiabatiques réversible et irréversible (8pts)
Un gaz parfait (de constantes R et
γ
)
subit une compression adiabatique de l’état (
1
1
T,P
) à
l’état (
2
P
). Exprimer toutes les réponses en fonction de ces données.
*
a) Compression réversible : calculer
2
T
,
2
V
, le travail
12
W échangé et l’entropie
c
S créée.
b) Compression irréversible : calculer
'
2
T
,
'
2
V
, le travail
'
12
W
échangé et l’entropie
'c
S créée.
-------------------------------------------------------------------------------

Indication de solution aux exercices du contrôle rattrapage
SMP S3 Automne 2012
Exercice 1 : Chaleur latente de vaporisation en fonction de la température (10pts)
2/ Calcul des travaux et des chaleurs échangés. Noter que 0,5pt pour l’expression et le signe
(c'est-à-dire 0,25pt pour l’expression et 0,25pt pour le signe).
Transformation isotherme EF :
'
P
P
ln'RTW
EF
−=
>0 (0.5pt)
'
P
P
ln'RTQ
EF
=
<0(0.5pt)
Où
E
'
g
EF
V
V
ln'RTW −=
E
'
g
EF
V
V
ln'RTQ =
Changement d'état FG :
)'V'V('PW
gfFG
−−=
>0(0.5pt)
'
gFG
V'PW ≈
'LQ
FG
−=
<0(0.5pt)
Transformation isobare GH : 0W
GH
≈
(0.5pt)
)'TT(CQ
fGH
−=
<0(0.5pt)
Transformation isotherme HI : 0W
HI
=
(0.5pt)
0Q
HI
=
(0.5pt)
Changement d'état I-->J : )VV(PW
fgIJ
−−=
<0(0.5pt)
gIJ
PVW
−≈
LQ
IJ
=
>0(0.5pt)
Transformation isobare J-->E : )VV(PW
gEJE
−−=
<0(0.5pt)
)T'T(CQ
gJE
−=
>0(0.5pt)
3/
Le premier principe de la thermodynamique, donne 0)QW(U
iicycle
=+Σ=∆
(0.5pt).
En utilisant l’équation des gaz parfaits et pour 1 mole, on obtient
)'TT)(CC('LL
gf
−−−=−
(0.5pt).
c'est-à-dire
aTLL
0
−=
avec
'T)CC('LL
gf0
−+=
(0.5pt) et
gf
CCa
−=
(0.5pt).
4/ D’après la question 3/ L(T) est approximé par une relation linéaire à pente négative, d’où la courbe :
5/ Quand
C
TT
→
,
fg
VV
→
et
0L
→
. Il s’agit donc de la température critique Tc (Liq/Vap) (0.5pt)
voir la courbe de la figure sur le texte de l’exercice.

Exercice 2 : Turbine (4pts)
1/ Le premier principe de la thermodynamique des systèmes ouverts :
t
2
1
2
2
12
W)
2
cc
hh(m &
&=
−
+−
(1pt), ce qui donne par A.N.
kW5,5307W
t
−=
&
(0.5pt)
2/
)TT(chh
12p12
−=−
⇒
1
p
12
2
T
chh
T+
−
=
(0.5pt) donne
K7,366T
2
=
(0.5pt).
3/ On a :
't
'
t
2
1
2
2
12
QW)
2
cc
hh(m &
&
&+=
−
+−
(0.5pt), d’où
m/)WW(Q
'
tt
't
&
&&
−=
(0.5pt). Par application
numérique, on obtient :
kg/kJ75,6875,530462Q
't
−=−=
(0.5pt).
Exercice 3 : Transformations adiabatiques réversible et irréversible (6pts)
a/ Transformation est adiabatique réversible : Gaz parfait :
1
1
1
RTVP =
donnent :
γ
−γ
=
1
1
2
12
P
P
TT
(0,5pt) et
γ
=
1
2
1
1
1
2
P
P
P
RT
V
(0,5pt),
)1
P
P
(
1
RT
)TT(cW
1
1
21
12v12
−
−γ
=−=
γ
−γ
(0.5pt) et S
c
= 0(0.5pt).
b) Transformation est adiabatique irréversible :
)TT(
1
R
W
1
'
2
'
12
−
−γ
=
et
)VV(PW
1
'
2
2
'
12
−−=
et
puisque
'
2
2
'
2
VPRT =
on obtient
121
'
2
VPT
1
R
1
R
T+
−γ
=
−γ
γ
- Calcul de
'
2
T
:
))1(
P
P
1(
T
1
P
T
P
T
T
1
21
1
1
2
1
'
2
−γ+
γ
=
γ
−γ
+
γ
=
donne
))1(
P
P
1(
T
T
1
21
'
2
−γ+
γ
=
(1pt)
- Calcul de
'
2
V
:
)1(
P
P
1
P
RT
Vou
R1
P
RT
P
T
P
R
V
1
2
2
1
'
2
1
1
2
1
2
'
2
−γ+
γ
=
γ−γ
+
γ
=
(1pt)
donne
)1(
P
P
1
P
RT
V
1
2
2
1
'
2
−γ+
γ
=
- Calcul de
'
12
W
:
)1
P
P
(
RT
)T
R1
VP
T
(
1
R
W
1
21
112
1
'
12
−
γ
=−
γ−γ
+
γ−γ
=
donne :
)1
P
P
(
RT
W
1
21
'
12
−
γ
=
(1pt)
En utilisant l’autre expression
]V))1(
P
P
1(
P
RT
[PW
1
1
2
2
1
2
'
12
−−γ+
γ
−=
on arrive au même résultat :

]
P
P
1[
RT
W
1
21
'
12
−
γ
−=
- Calcul de
'c
S
: Il est plus simple d’utiliser la pression,
2
1
1
'
2
P
2
1
'c
P
P
lnR
T
T
lnc
T
Q
SS +=
δ
=∆=
∫
(0.5pt),
ce qui donne
2
1
1
2
'c
P
P
lnR))1(
P
P
1(
1
ln
1
R
S+
−γ+
γ−γγ
=
(0.5pt)
Si non on utilisera le volume et on aura :
1
'
2
1
'
2
V
2
1
'c
V
V
lnR
T
T
lnc
T
Q
SS +=
δ
=∆=
∫
qui donne :
−γ+
γ
+
−γ+
γ−γ
=)1(
P
P
1
P
P
lnR))1(
P
P
1(
1
ln
1
R
S
1
2
2
1
1
2
'c
, que l’on peut ramener à l’expression ci-
dessus.
1
/
4
100%