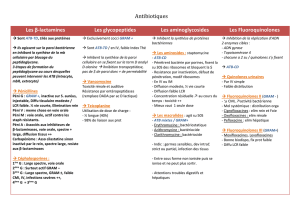
Les Béta lactamines

Marie FAOUCHER
Julien SOURISSE
Mercredi 27 octobre 2010
Pharmacologie, Les anti-infectieux, MC VERDIER-LORNE
Le diaporama est disponible sur le réseau pédagogique.
Les Béta lactamines
Introduction : les anti-infectieux
A) Un peu d’histoire…
1877: antagonisme entre moisissures et microbes
1928 : Alexander Fleming: inhibition de la pousse bactérienne par un champignon, un Penicillium
(prix Nobel)
1935 : 1er sulfamide administré chez l’homme: début de l’antibiothérapie!
1942 : essais cliniques de la pénicilline, puis son utilisation s’est très rapidement étendue (guerre)
1944 : Waksman isole la streptomycine (prix Nobel)
1947- 1957 : âge d’or de l’antibiothérapie
1979 : mise sur le marché de la fosfomycine seule molécule antibiotique de structure originale
durant cette longue période
2000- : linézolide, daptomycine, tigécycline…
B) Relation triangulaire médicament/micro-
organisme/hôte.
I) Pharmacologie des bêta lactamines.
–Les plus courantes.
–Les plus anciennes.
–administrables par voie orale et IV .
–assez peu toxiques pour l'organisme.
Patient
Anti-infectieux
Micro-organisme
Pharmacocinétique
Effets indésirables
Effet recherché : bactéricide/bactériostatique
Pression de sélection -> Résistance
Infection
Immunité

A) Classification des bêta lactamines
4 grandes catégories :
–Les pénicillines = pénames (13)
–Les céphalosporines = céphèmes (17)
–Les pénèmes (4)
–Les monobactames (1)
B) Mécanisme d’action
– Liaison aux penicillin-binding proteins (PBP) insérées dans la membrane cytoplasmique.
Les PBP ont une activité transpeptidase qui intervient dans la synthèse du peptidoglycan
(élément de structure des parois bactériennes).
–Action sur la paroi bactérienne : par analogie de structure avec le substrat dipeptide D-Ala –
D-Ala ce qui inhibe l'assemblage du peptidoglycan.
Les béta lactamines inhibent l'action des PBP donc la synthèse complète de la paroi ce qui aboutit à
la mort de la bactérie.
Cette activité fonctionne chez les GRAM + et – mais chez les GRAM- pour atteindre les PBP, les
bétalactamines doivent traverser la paroi externe par les porines. Ce qui conditionne leur spectre
d'activité.
C) Resistance
2 grands types de résistance :
Enzymatique : bêtalactamases (plasmidiques ou chromosomiques)
de + en + fréquentes chez les Gram(-)
dégradation de l'antibiotique (possibilité de blocage sans hydrolyse)

Non enzymatique :
–Perméabilité membranaire : diminue le passage des béta lactamines à travers les
porines
. La pénétration se fait en fonction :
. de la taille de la molécule
. des charges négatives
. de l'hydrophilie
–Modification quantitative ou structurale des PBP
principal mécanisme chez les bactéries à gram (+)
→ PBP moins affines
–Efflux
D) Pharmacodynamie
Bactéricides (sauf vàv des entérocoques)
Activité temps-dépendant
La Bactéricidie augmente si le temps où la [c] > CMI.
On considère que la concentration plasmatique doit être 4 à 5 fois superieure à la CMI le plus
longtemps possible pour avoir un effet optimal pour les béta lactamines il est donc nécessaire
d'avoir recours à des administrations répétées (peut aller jusqu'à 8 fois par jour en cas d'infection
grave) ou une perfusion continue.
Pratiquement pas d'effet post-antibiotique.
L'effet post-antibiotique est le fait que l'antibiotique soit encore actif sur la bactérie alors qu'il n'est
plus détectable dans l'organisme.
Effet inoculum-dépendant: CMI augmente avec le nombre de bactéries présentes. (surtout in
vitro)
Effet synergique avec les aminosides; additif avec les fluoroquinolones.
Objectifs therapeutiques :
Profil plasmatique à obtenir avec des antibiotiques temps dépendant.
En général il faut avoir une concentration supérieure à la CMI 50 à 60% du temps.
CMI
Dose
Concentration
Temps

Adaptation de posologie :
La dose 1 n'est pas assez longtemps au dessus de la CMI c'est pourquoi on la double. On obtient
donc le profil de la dose 2. Mais le temps au dessus de la CMI n'est toujours pas satisfaisant. L'idée
est donc de rapprocher les administrations
II) Les Pénicillines = Pénames.
A) Structure chimique
Il existe des noyaux dérivés avec des radicaux chimiques différents
(pénicilline G, méticilline, ampicilline, carbenicilline)
NB : La méticilline n'est plus commercialisée car trop toxique mais elle reste une
référence en ce qui concerne les mécanismes de résistance des différents germes
On associe souvent des inhibiteurs béta lactamases aux béta lactamines ce qui potentialise leur effet.
Ces inhibiteurs n'ont pas d'activité anti-bacterienne propre.
B) Pharmacocinétique
1) La résorption
➢Très variable d’un ATB à l’autre.
➢Par voie orale, ils peuvent être détruits par le pH gastrique et les pénicillinases intestinales.
➢Ils passent la barrière intestinale par des transporteurs dipeptides intestinaux.
2) La distribution
➢Taux de fixation aux protéines plasmatiques assez faible (20-50 %)
➢Concentration tissus = concentration sérique.
➢Passage trans-placentaire et passage dans le lait.
➢Peu de diffusion dans LCR sauf en cas de méningite ou de syndrome inflammatoire.
Noyau
péname
NOYAU
BETA-LACTAM

3) L’élimination
➢ Demi-vie brève: 30 à 60 minutes.
➢Elimination rénale majoritaire : filtration et sécrétion 90 %
➢Doses à adapter en fonction de la clairance rénale. Si la clairance diminue on diminue la
posologie.
4) Propriétés des différentes pénicillines.
●Péni G et V:
Demi-vie très courte: 30 min
Diffusion correcte méninges.
Par voie orale: biodisponibilité ≈ 50%.
●Péni-A :
Biodisponibilité orale 90% pour l’amoxicilline.
Bonne diffusion, même LCR.
●Péni-M :
Faible diffusion os, prostate, LCR.
Forte liaison aux protéines.
Oxacilline: métabolisme hépatique mauvaise biodisponibilité orale (30%)
Méticilline: tox rénale: retirée du marché.
●Pipéracilline :
Bonne diffusion
Élimination essentiellement urinaire, mais non négligeable par voie hépatique.
C) Effets indésirables
•Peu toxiques, même à fortes doses
•Réactions allergiques: la plupart du temps croisées à toutes les b-lactamines.
✔immédiates (min): production d’IgE
•réactions cutanées: érythème, urticaire, bronchospasme, hypotension
•choc anaphylactique
✔accélérées (1-72h): production d ’IgG et IgE
•réactions cutanées - choc + œdème laryngé
✔retardées (> 72h) : production d ’IgM et IgG
•exanthèmes maculopapuleux, épidermolyse bulleuse
•fièvre; cytopénie; néphropathies
•Troubles neurologiques :
encéphalopathies avec risque de convulsions à fortes doses, tremblements, mouvements anormaux,
troubles de la conscience.
•Troubles de l’agrégation plaquettaire
pénicillines G, carboxy et uréidopénicillines
•Troubles gastro-intestinaux
diarrhée, candidose avec les inhibiteurs de bêta-lactamases surtout chez l’enfant.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%