Sarcomes : état des lieux du référentiel

Prise en charge des sarcomes des
tissus mous non métastatiques
4ème Journée Régionale du RCA
25 novembre 2005
BN. Bui - Institut Bergonié

Recommandations régionales
Prise en charge des sarcomes des tissus
mous non métastatiques
Version 1
Octobre 2005
RECOMMANDATIONS POUR LA PRATIQUE CLINIQUE
Standards, Options et Recommandations 2005
pour la prise en charge des patients adultes
atteints de sarcome des tissus mous, de sarcome
utérin ou de tumeur stromale gastro-intestinale
Mise à jour
Validation du document initial : 1995
Validation de la dernière mise à jour : en cours

SOR sarcomes 1995
STS de l ’adulte, ostéosarcomes.
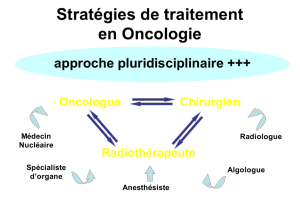
Multidisciplinarité nécessaire (tumeurs
rares, difficiles)
ordonnance sur les réseaux:1996
Bilan?

ONCOLOR: referral to a regional multidisciplinary
commitee
Retrospective analysis on 118 sarcoma patients seen in
2000 at the reference center
Osteosarcomas: 6
Conformity to SOR: 100%
Soft tissue sarcomas
25/34 adequate initial imaging
Biopsy prior surgery: 16/34
Multidisciplinary concertation
before biopsy: 4/34
Before 1rst surgery:8/34
After 1rst surgery: 20/34 (59%)
After post-op treatment: 2/34
Uwer et al., Bull cancer 2003; 90:269-77

ONCORA Study
Patient characteristics
Anatomic location of the tumor: (n=100)
Clinical management
Organizing physician:
medical oncologist 61% pts: 80% post-biopsy
Healthcare network:
67%, only 50% post-biopsy
pre-biopsy multidisciplinary cooperation: 7%
Initial biopsy: 42%
histological diagnosis at biopsy: 93%
deviation at biopsy: 65%
Initial staging: 82%
Extremities
36
Head & Neck
7
Abdominal wall
19
Viscera -
inner trunkal region
38
Ray-Coquard, Ann oncol, 2004; 15: 307-15
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
1
/
34
100%