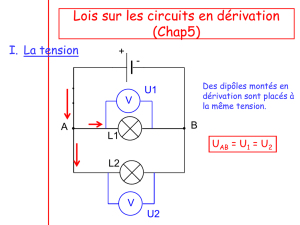
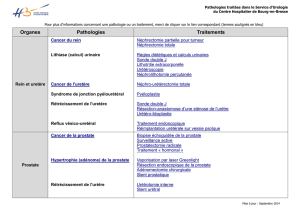
Traitement chirurgical des tumeurs infiltrantes de vessie

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
126
dossier thématique
Vessie :
le point sur les traitements
adjuvants et néo-adjuvants
Traitement chirurgical
des tumeurs infiltrantes de vessie
Radical surgery and urinary diversion for muscle-invasive bladder cancer
A. Daché*, N. Barry-Delongchamps*, M. Zerbib*
L
a cystectomie totale est le traitement de réfé-
rence du cancer infiltrant de la vessie (1). L’état
général du patient et son âge doivent être pris
en compte lors du choix de la chirurgie et du type
de dérivation urinaire, car les résultats en termes de
complications et de survie après cystectomie totale
sont corrélés aux comorbidités du patient, en parti-
culier au score ASA (2). Le délai entre le diagnostic
de cancer de la vessie et la cystectomie totale est
un critère pronostique du résultat carcinologique
et des possibilités de dérivation urinaire. Selon la
plupart des études, ce délai devrait être inférieur à
90 jours (3, 4).
La cystectomie totale est indiquée chez les patients
ayant un carcinome infiltrant de la vessie T2-T4a,
N0-Nx, M0 (1). Les autres indications sont les tumeurs
superficielles à haut risque, récidivantes après résec-
tion endoscopique de la vessie (RTUV) et échec des
instillations endovésicales de BCG : ce sont les tumeurs
de haut grade, les tumeurs T1 et les carcinomes in
situ (CIS).
La cystectomie totale peut aussi être proposée à visée
palliative en cas de fistule urinaire tumorale ou de réci-
dive postradique, ou encore d’hématurie macrosco-
pique récidivante (5).
Cystectomie totale
Cystoprostatectomie totale chez l’homme
La voie d’abord de référence est la laparotomie médiane
sous-ombilicale. L’intervention débute par l’abord de
l’espace de Retzius et la réalisation d’une lymphadénec-
tomie étendue bilatérale. Après ouverture de l’aponé-
vrose pelvienne de part et d’autre de la prostate, le
plexus de Santorini est lié puis sectionné, ce qui permet
d’exposer l’urètre. Celui-ci est sectionné, en respectant le
sphincter strié lorsqu’un rétablissement de la continuité
urinaire est envisagé. La dissection se poursuit sur la face
postérieure de la prostate. L’ouverture de l’aponévrose
de Denonvilliers permet d’accéder au plan des canaux
déférents et des vésicules séminales. Les canaux déférents
* Service d’urologie,
hôpital Cochin, Paris.
Points forts
highlights
»
La cystectomie totale est le traitement curatif de référence du cancer
infiltrant de vessie non métastatique.
»
L’intervention consiste en une cystoprostatectomie totale chez
l’homme et en une pelvectomie antérieure chez la femme.
»
Il existe 2 types de dérivation urinaire : anatomique et extra-anatomique.
»
Les principales complications sont liées au mode de dérivation urinaire.
»
Les stades tumoral et ganglionnaire sont les facteurs prédictifs majeurs
de survie.
»
Le taux de survie globale varie de 58 à 84 % à 5 ans pour les tumeurs
de stade inférieur ou égal à pT2N0 et il est inférieur à 50 % pour les
tumeurs de stade supérieur ou égal à pT3.
Mots-clés : Cancer infiltrant de la vessie – Cystectomie totale – Dérivation
urinaire – Intervention de Bricker – Entéro-cystoplastie.
Radical cystectomy is the gold standard treatment for
non-metastatic muscle-invasive bladder cancer.
The surgery consists in radical cystoprostatectomy for
men and anterior pelvectomy for women.
Main complications are related to the type of urinary
diversion.
Tumour and nodal status are the main predictive factors
of survival.
The 5-year overall survival rate ranges between 58 and
84% for tumors up to pT2N0 and lower than 50% for
tumors pT3 or higher.
Keywords: Muscle invasive bladder cancer – Radical cys-
tectomy – Urinary diversion – Ileal conduit – Orthotopic
neobladder.

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
127
Traitement chirurgical des tumeurs infiltrantes de vessie
sont sectionnés et les vésicules séminales libérées de leurs
attaches au plancher pelvien, ce qui permet de poursuivre
la dissection jusqu’à la face postérieure du col vésical.
On se porte ensuite au niveau de la face postérieure de la
vessie, qui est libérée en haut et en avant par section de
l’ouraque. Le péritoine est ouvert, ce qui permet d’exposer
le dôme et le fond vésical. Les faces latérales de la vessie
sont libérées après section de la partie haute des canaux
déférents et section des 2 artères ombilicales. La dissec-
tion se poursuit latéralement et en arrière jusqu’au trigone
vésical. Les uretères pelviens sont libérés et sectionnés
sur clip. Les 2 plans de dissection (rétroprostatique et
vésical) se rejoignent en avant du rectum, la vessie n’étant
fixée au plancher pelvien que par ses attaches postéro-
latérales. Celles-ci sont ligaturées puis sectionnées, et la
pièce opératoire est extraite en un bloc comprenant la
vessie, la prostate et les vésicules séminales.
À ce stade de l’intervention se pose le problème du
mode de dérivation urinaire. Des recoupes urétérales
et une recoupe urétrale sont adressées pour examen
extemporané afin de confirmer l’absence d’atteinte
carcinomateuse. En cas d’envahissement urétéral, des
recoupes sont effectuées en zone saine. La présence d’un
envahissement urétral contre-indique un rétablissement
anatomique de la continuité urinaire (entérocystoplastie),
et pose l’indication d’une urétrectomie complémentaire.
Cystoprostatectomie avec préservation
de la coque prostatique
La préservation de la coque prostatique nécessite de réa-
liser une résection endoscopique de prostate de stadifica-
tion afin d’éliminer une extension tumorale prostatique.
Cette technique a pour objectif de diminuer le risque
d’incontinence urinaire et d’insuffisance érectile post-
opératoire (6). En effet, la préservation de la capsule pros-
tatique permet, d’une part, de préserver les bandelettes
vasculo-nerveuses et, d’autre part, d’augmenter la lon-
gueur urétrale et de conserver les attaches anatomiques
pelviennes de l’urètre (ligaments pubo-prostatiques,
aponévrose pelvienne). Néanmoins, l’évaluation de cette
technique a montré de mauvais résultats carcinologiques.
Une étude prospective publiée en 2004 ayant porté sur
34 patients a rapporté un taux de métastases précoces de
18 % après un suivi moyen de 26 mois (7, 8). Cette tech-
nique chirurgicale n’est donc plus proposée actuellement.
Cystectomie totale chez la femme
(pelvectomie antérieure)
Chez la femme, l’intervention de référence est la pelvec-
tomie antérieure emportant la vessie, l’utérus et la paroi
antérieure du vagin. La conservation ovarienne dépend
de l’état hormonal de la patiente.
L’incision est médiane sous-ombilicale et la voie
d’abord est transpéritonéale. L’intervention débute
par une lymphadénectomie ilio-obturatrice bilatérale.
L’hystérectomie commence par la ligature-section du
ligament rond de part et d’autre de l’utérus. La dis-
section se prolonge par l’incision du péritoine latéral
entre les ligaments ronds et lombo-ovariens, puis
l’ouverture du feuillet postérieur du ligament large
jusqu’à l’insertion utérine des ligaments utéro-sacrés.
Les artères utérines et cervico-vaginales sont liées, ce
qui permet de pédiculiser l’isthme utérin et d’ouvrir le
cul-de-sac vaginal postérieur. Le dôme vésical est libéré
par ligature-section de l’ouraque. La face antérieure
du col de la vessie est libérée par ligature-section du
plexus de Santorini, ce qui expose l’urètre et la face anté-
rieure du vagin. Les 2 uretères sont disséqués dans leur
portion pelvienne et sectionnés sur clip. À ce stade de
l’intervention, le bloc constitué par la vessie et l’utérus
n’est plus retenu que par l’urètre, la paroi antérieure
du vagin et les ailerons vésicaux latéraux. Une fois ces
éléments sectionnés, la pièce opératoire est extraite,
et une analyse extemporanée des recoupes urétrales
et urétérales est réalisée. L’intervention s’achève par la
fermeture du vagin puis la dérivation des urines.
Cystectomie totale chez la femme
avec préservation urétrale et remplacement
de la vessie
Dans certains cas particuliers, l’exérèse peut être
limitée en préservant le bloc utéro-vaginal. Cela est
possible sur le plan carcinologique en cas de tumeur
vésicale respectant le plan postérieur et de tumeur
limitée n’infiltrant que superficiellement le muscle
vésical. La conservation de la paroi antérieure du vagin
et de l’urètre permet donc techniquement de réaliser
une dérivation anatomique des urines. Il est conseillé
de ne pas réaliser d’hystérectomie afin de limiter le
risque de rétention postopératoire lié au basculement
de la néovessie dans le pelvis. Néanmoins, les résultats
fonctionnels après entérocystoplastie chez la femme
sont moins bons que chez l’homme, et ce type de
dérivation n’est réalisé que chez les femmes jeunes
et motivées (9).
Cystectomie totale et laparoscopie
(cœlioscopie et robot)
Les cystectomies totales laparoscopique et robot-
assistée peuvent être effectuées selon les mêmes
principes que la voie ouverte chez l’homme et chez
la femme. Ces techniques restent néanmoins expéri-
mentales en l’absence de résultats carcinologiques et
fonctionnels fiables (10-13).

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
128
dossier thématique
Vessie :
le point sur les traitements
adjuvants et néo-adjuvants
Figure 2. Entérocystoplastie avec détubulisation en “Z” (image extraite
du rapport AFU 2002, avec l’aimable autorisation du Pr Zerbib).
Figure 1. Dérivation urinaire de type Bricker (image extraite
du rapport AFU 2002, avec l’aimable autorisation du Pr Zerbib).
Dérivations urinaires
après cystectomie totale
Généralités
Les dérivations urinaires après cystectomie totale sont
classées en deux catégories : les dérivations externes
cutanées (continentes et non continentes) et les déri-
vations internes (14, 15).
Parmi les dérivations externes cutanées, l’intervention
de référence est l’urétérostomie cutanée transiléale
(intervention de Bricker). Parmi les dérivations urinaires
internes, on distingue les dérivations orthotopiques
(vessie de remplacement tubulée ou détubulée) et les
dérivations recto-sigmoïdiennes.
Urétérostomies cutanées trans-iléales
(dérivation de Bricker)
Il s’agit d’une dérivation externe cutanée non conti-
nente (figure 1). Elle est indiquée sur le plan carcino-
logique en cas d’envahissement urétral, du col vésical
ou de l’urètre prostatique.
Après avoir repéré la dernière anse grêle (à 20 cm de
la jonction iléo-cæcale), un segment de 10 à 15 cm
de l’intestin grêle est prélevé avec son méso par liga-
tures-sections du mésentère et section du tube digestif.
La continuité digestive est rétablie par l’anastomose
des segments d’amont et d’aval de l’iléon. La partie
proximale du segment de l’intestin grêle prélevé est
fermée par un surjet de fil résorbable, la partie d’aval
étant laissée ouverte en vue de la stomie.
Après avoir libéré les 2 uretères jusqu’à leur portion
lombaire, on fait passer l’uretère gauche à droite, sous la
racine du mésentère. Deux anastomoses urétéro-iléales
sont réalisées, le plus souvent en implantant directe-
ment les uretères sur la partie proximale du segment
iléal prélevé. Ces anastomoses sont réalisées sur des
sondes urétérales afin de diminuer le risque de fistule et
de sténose postopératoire. La partie distale du segment
iléal prélevé est montée à la peau en péri-ombilical droit,
puis fixée par des points séparés. Les sondes urétérales
sont extériorisées par l’iléostomie.
Entéro-cystoplasties de substitution
Le résultat fonctionnel d’une entérocystoplastie dépend
essentiellement de la sélection rigoureuse des patients.
Il est important de préciser que l’objectif principal de la
chirurgie est le résultat carcinologique. Ainsi, en cas de
maladie évoluée, lorsque l’espérance de vie est limitée,
une entérocystoplastie ne paraît pas justifiée.
Plusieurs techniques ont été proposées, celles utili-
sant une vessie détubulée étant les plus couramment
proposées. Parmi ces techniques, la plus pratiquée est
l’entérocystoplastie avec détubulisation en “Z” (figure 2),
en “M” ou en “W”, selon Hautmann.
Urétérostomies cutanées
Ce type de dérivation est le plus simple à réaliser techni-
quement, car il ne nécessite pas de prélèvement digestif.
Les suites chirurgicales sont elles aussi plus simples, en
raison de l’absence d’anastomose digestive. Les urété-
rostomies cutanées peuvent donc être proposées aux
patients fragiles ou ayant des antécédents digestifs ne
permettant pas le prélèvement intestinal. Néanmoins,
ce mode de dérivation nécessite la réalisation de deux
stomies cutanées, et les soins à long terme sont plus
lourds, car les uretères doivent être intubés en perma-
nence par des sondes spécifiques afin d’éviter une sténose.

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
129
Traitement chirurgical des tumeurs infiltrantes de vessie
Complications postopératoires
Le taux rapporté de mortalité périopératoire est infé-
rieur à 1 %. Les complications postopératoires pré-
coces concernent jusqu’à un tiers des patients. Elles
sont dominées par les iléus prolongés et les fistules
anastomotiques digestives. Les complications tardives
(après 3 mois) sont habituellement classées en quatre
catégories : mécaniques, métaboliques, infectieuses et
lithiasiques (16).
✓
Complications mécaniques. Il s’agit de complica-
tions liées au mode de dérivation des urines. La sténose
de l’anastomose urétéro-digestive est la complication
tardive la plus fréquente. Le reflux urétéral est une
autre complication mécanique après cystectomie
totale.
✓
Complications métaboliques. La dérivation urinaire
selon Bricker n’entraîne quasiment aucune modification
métabolique. En revanche, les entérocystoplasties sont
à l’origine de modifications métaboliques. Celles-ci
sont spécifiques au segment intestinal concerné par la
reconstruction. L’utilisation d’un segment iléo-colique
peut entraîner une malabsorption de la vitamine B12,
tandis que l’utilisation d’un segment colique expose
à une acidose hyperchlorémique.
✓
Complications infectieuses. Les principales compli-
cations infectieuses sont les pyélonéphrites sur obstacle
ou liées à un reflux urétéral. Près de 80 % des patients
porteurs d’une dérivation cutanée, continente ou non,
ont une bactériurie asymptomatique, qui ne nécessite
aucun traitement prophylactique. Environ 40 % des
patients porteurs d’une vessie de remplacement ont
une bactériurie asymptomatique, qui peut favoriser la
formation de calculs.
✓Complications lithiasiques. La maladie lithiasique
est moins fréquente en l’absence de vessie de rem-
placement. Les calculs sont localisés principalement
au niveau du haut appareil urinaire. Néanmoins, ils
peuvent aussi se former au niveau du réservoir ou de
la néovessie en cas de bactériurie asymptomatique ou
de résidu postmictionnel chronique.
Surveillance après cystectomie totale
La surveillance est à la fois carcinologique et fonctionnelle.
Sur le plan carcinologique
Le rythme de la surveillance est rapproché durant les
deux premières années (tous les 3 mois), puis il est
semestriel jusqu’à 5 ans, et enfin annuel.
L’examen morphologique de référence est la tomo-
densitométrie (TDM) thoraco-abdomino-pelvienne,
à la recherche d’une récidive locale ou d’une seconde
localisation (haut appareil), d’une récidive ganglionnaire
ou métastatique.
Sur le plan biologique, la cytologie urinaire permet de
dépister une récidive tumorale du haut appareil (ou
urétrale en cas de dérivation interne).
Une surveillance du PSA est réalisée en cas de décou-
verte fortuite d’un cancer de la prostate sur la pièce de
cystoprostatectomie.
Sur le plan fonctionnel
La surveillance repose sur l’évaluation de la fonction rénale
et du bon fonctionnement du montage de dérivation.
Elle dépend donc du type de dérivation, chacun pouvant
être à l’origine de complications spécifiques.
Dans tous les cas, les urines sont colonisées par des
germes, ce qui ne constitue pas un critère d’instauration
d’une antibiothérapie.
✓
En cas de dérivation de Bricker. Les sondes uré-
térales sont habituellement retirées après un délai de
1 mois postopératoire.
L’uro-TDM permettra de rechercher une sténose anas-
tomotique (urétéro-digestive) à l’origine d’un retard
excrétoire.
✓
En cas d’entérocystoplastie. Les sondes JJ sont
retirées en consultation après un délai de 1 mois post-
opératoire. De même, l’uro-TDM permettra de mettre
en évidence une sténose anastomotique.
Contrairement aux patients ayant eu une dérivation de
type Bricker, ceux ayant une entérocystoplastie présen-
tent un risque de stase urinaire et de lithiase au niveau
de la néovessie, ainsi que de reflux urétéral. L’évaluation
du résidu postmictionnel est donc essentielle.
La surveillance biologique doit dépister une complica-
tion métabolique (ionogramme sanguin, dosage de la
vitamine B12 sérique).
✓
En cas d’urétérostomies cutanées. Ce mode de
dérivation nécessite des sondes urétérales permanentes
pour éviter une sténose des urétérostomies. Ces sondes
sont donc changées toutes les 6 semaines.
Résultats carcinologiques et fonctionnels
Résultats carcinologiques
Le stade TNM et la présence d’un envahissement gan-
glionnaire sont les principaux facteurs prédictifs de
survie (17-19).
Pour les tumeurs de stade inférieur ou égal à pT2N0,
le taux de survie globale à 5 ans varie entre 58 et 84 %
en fonction des séries. En cas de cancer localement
avancé, il descend au-dessous de 50 %.

Correspondances en Onco-urologie - Vol. I - n° 3 - octobre-novembre-décembre 2010
130
dossier thématique
Vessie :
le point sur les traitements
adjuvants et néo-adjuvants
Les taux de survie sans récidive et de survie spécifique
à 5 ans sont de 58 % et 66 % dans une série récente
de patients traités pour cancer localisé ou localement
avancé de la vessie non métastatique (17). Dans cette
étude, l’âge, la présence de CIS ou d’un envahissement
lympho-vasculaire sur la pièce de cystectomie étaient
également associés à la survie sans récidive (17).
Dans une autre étude rétrospective, la survie a été
évaluée chez 686 patients en fonction du statut gan-
glionnaire. En cas de cancer localisé et d’absence d’at-
teinte ganglionnaire, les taux de survie globale, de
survie spécifique et de survie sans récidive à 10 ans
étaient de 73 %, 62 % et 33 %. En cas de cancer locale-
ment avancé (≥ pT3), ils descendaient à 50 %, 41 % et
23 %. En cas d’atteinte ganglionnaire, la survie spéci-
fique et la survie globale étaient de 28 % et 21 % (18).
Dans une autre étude (19), les taux de survie sans
récidive à 5 ans ont été évalués en fonction du stade
tumoral : ils étaient de 76 % chez les patients ayant une
tumeur pT1, de 74 % en cas de pT2, de 52 % en cas de
pT3 et de 36 % en cas de pT4 (19).
Résultats fonctionnels
✓Continence. Chez l’homme, le taux de continence
postopératoire après entérocystoplastie varie entre 80 %
et 100 % le jour et entre 50 % et 80 % la nuit, sous réserve
d’avoir 1 ou 2 levers. Chez la femme, il est similaire,
avec néanmoins un risque de rétention évalué à 15 %.
✓
Sexualité. Chez l’homme, en l’absence de conser-
vation des bandelettes vasculo-nerveuses, le taux rap-
porté de dysfonction érectile est de 80 %. Il diminue
à 40 % en cas de conservation des bandelettes. Chez
la femme, la cystectomie entraîne fréquemment une
dyspareunie.
✓
Qualité de vie et mode de dérivation urinaire. Il
est vraisemblable que chaque patient porteur d’une
dérivation urinaire souffre de difficultés spécifiques à la
dérivation choisie, ce qui finalement aboutit à un reten-
tissement sur la qualité de vie globalement identique.
Il a été montré que, pour avoir une meilleure qualité de
vie après l’opération, il faut que le patient ait participé à
la décision du type de dérivation urinaire choisi.
Conclusion
La cystectomie totale est l’intervention de référence en
cas de cancer de la vessie non métastatique. Le choix
de la dérivation urinaire doit reposer sur des critères
carcinologiques, mais aussi sur une discussion entre
le patient et son chirurgien afin que la qualité de vie
après l’opération soit la meilleure possible.
■
1. Hautmann RE, Abol-Enein H, Hafez K et al. Urinary diversion.
Urology 2007;69(Suppl.1):17-49.
2. Miller DC, Taub DA, Dunn RL et al. The impact of co-mor-
bid disease on cancer control and survival following radical
cystectomy. J Urol 2003;169(1):105-9.
3. Chang SS, Hassan JM, Cookson MS et al. Delaying radical
cystectomy for muscle invasive bladder cancer results in worse
pathological stage. J Urol 2003;170(4Pt1):1085-7.
4.
Sánchez-Ortiz RF, Huang WC, Mick R et al. An interval lon-
ger than 12 weeks between the diagnosis of muscle invasion
and cystectomy is associated with worse outcome in bladder
carcinoma. J Urol 2003;169(1):110-5;discussion115.
5. Ok J, Meyers FJ, Evans CP. Medical and surgical pallia-
tive care of patients with urological malignancies. J Urol
2005;174(4Pt1):1177-82.
6. Vallancien G, Abou El Fettouh H, Cathelineau X et al.
Cystectomy with prostate sparing for bladder cancer in
100 patients: 10-year experience. J Urol 2002;168(6):2413-7.
7. Botto H, Sebe P, Molinie V et al. Prostatic capsule and semi-
nal-sparing cystectomy for bladder carcinoma: initial results
for selected patients. BJU Int 2004;94(7):1021-5.
8. Kefer JC, Campbell SC. Current status of prostate-sparing
cystectomy. Urol Oncol 2008;26(5):486-93.
9. Mottet N, Castagnola C, Rischmann P et al. Quality of life
after cystectomy: French national survey conducted by the
French Association of Urology (AFU), the French Federation
of Stoma Patients (FSF) and the French Association of
Enterostomy Patients (AFET), in patients with ileal conduit
urinary diversion or orthotopic neobladder. Prog Urol
2008;18(5):292-8.
10. Chade DC, Laudone VP, Bochner BH, Parra RO. Oncological
outcomes after radical cystectomy for bladder cancer: open
versus minimally invasive approaches. J Urol 2010;183(3):862-9.
11.
Kasraeian A, Barret E, Cathelineau X et al. Robot-assisted
laparoscopic cystoprostatectomy with extended pelvic
lymphadenectomy, extracorporeal enterocystoplasty, and
intracorporeal enterourethral anastomosis: initial Montsouris
experience. J Endourol 2010;24(3):409-13.
12. Hautmann RE. The oncologic results of laparoscopic radical
cystectomy are not (yet) equivalent to open cystectomy. Curr
Opin Urol 2009;19(5):522-6.
13.
Ng CK, Kauffman EC, Lee M et al. A comparison of post-
operative complications in open versus robotic cystectomy.
Eur Urol 2010;57(2):274-81.
14.
Stenzl A. Bladder substitution. Curr Opin Urol 1999;9(3):241-5.
15. Pruthi RS, Nielsen M, Smith A et al. Fast track program in
patients undergoing radical cystectomy: results in 362 conse-
cutive patients. J Am Coll Surg 2010;210(1):93-9.
16.
Stein JP, Skinner DG. Radical cystectomy for invasive blad-
der cancer: long-term results of a standard procedure. World
J Urol 2006;24(3):296-304.
17.
Shariat SF, Karakiewicz PI, Palapattu GS et al. Outcomes of
radical cystectomy for transitional cell carcinoma of the blad-
der: a contemporary series from the Bladder Cancer Research
Consortium. J Urol 2006;176(6Pt1):2414-22;discussion2422.
18. Gschwend JE, Dahm P, Fair WR. Disease specific survival
as endpoint of outcome for bladder cancer patients following
radical cystectomy. Eur Urol 2002;41(4):440-8.
19. Madersbacher S, Hochreiter W, Burkhard F et al. Radical
cystectomy for bladder cancer today--a homogeneous series
without neoadjuvant therapy. J Clin Oncol 2003;21(4):690-6.
R é f é r e n c e s
1
/
5
100%