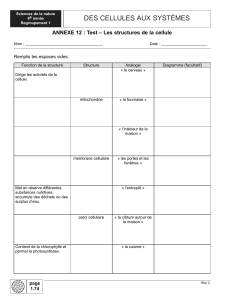
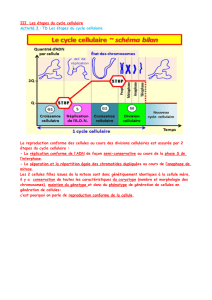
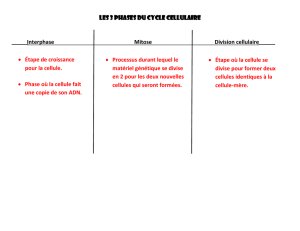
Lire l'article complet

28
CMV : Pouvez-vous nous situer l’épidémio-
logie de l’insuffisance cardiaque, car on a
l’impression, probablement à tort, qu’avec
les progrès des thérapeutiques, cette patho-
logie a diminué ?
Michel Desnos : L’insuffisance cardiaque est
au contraire la seule maladie cardiovasculaire
dont la fréquence augmente de façon indiscu-
table dans les pays dits développés. En
France, on estime qu’il y a entre 500 000 et
1 million d’insuffisants cardiaques. L’insuf-
fisance cardiaque peut s’observer à tout âge
mais, bien sûr, augmente avec l’âge, et le
vieillissement de la population explique
l’augmentation de l’incidence de la maladie
dans nos pays. La seconde raison à cette aug-
mentation de fréquence tient au progrès des
thérapeutiques de la phase aiguë de la mala-
die coronaire, avec le fait que nous sommes
capables de sauver des patients qui aupara-
vant mouraient rapidement ; mais, revers de
la médaille, ces patients gardent des séquelles
myocardiques importantes de leur maladie
coronaire. L’insuffisance cardiaque est donc
un grand problème de santé publique et,
comme le disent nos collègues nord-améri-
cains, elle sera l’épidémie du XXIesiècle.
CMV : Malgré les progrès dans le traite-
ment de l’insuffisance cardiaque par les trois
grandes classes thérapeutiques que sont les
inhibiteurs de l’enzyme de conversion, les
diurétiques et les bêtabloquants, a-t-on une
idée du pourcentage de patients qui échap-
pent à ce traitement ?
MD : Les progrès du traitement de l’insuffi-
sance cardiaque ont été majeurs depuis le trai-
tement empirique digitalo-diurétique utilisé il y
a 20 ans. Depuis 15 ans, les progrès ont été
réalisés grâce, d’une part, aux données de la
recherche montrant que l’insuffisance car-
diaque était liée à un remodelage ventriculaire
continu et aux stimulations neuro-hormo-
nales initialement bénéfiques puis délétères
et, d’autre part, aux résultats des grands
essais randomisés, malgré leurs limites, qui
ont permis de poser les bases du traitement
selon les critères actuels de la médecine fac-
tuelle (evidence-based medicine). On dispose
actuellement de trois classes thérapeutiques :
les inhibiteurs de l’enzyme de conversion, les
bêtabloquants à faible dose et la spironolacto-
ne, qui ont démontré leur efficacité sur la
baisse de la mortalité. Il faut néanmoins être
conscient qu’avec ces traitements, on prolonge
la vie de nos patients, mais on n’a pas la
solution du traitement de l’insuffisance
cardiaque.
CMV : Vous avez été les pionniers avec
l’équipe du Pr Menasché dans le traitement
par thérapie cellulaire. Pouvez-vous nous
donner les bases du concept de la thérapie
cellulaire, dont on parle beaucoup à l’heure
actuelle à propos des cellules souches ?
MD : Le cœur est constitué principalement
de cardiomyocytes, dont le pool est formé dès
la naissance, de la même façon que le pool de
cellules nerveuses qui est également fixe.
C’est donc un organe bien différencié, et lors-
qu’il y a perte de cardiomyocytes, il ne peut y
avoir de régénération ; cela est au contraire
couramment observé dans d’autres organes
comme le foie, la peau et le muscle périphé-
rique. On sait que l’insuffisance cardiaque est
essentiellement liée à la cardiopathie isché-
mique, et que l’un des déterminants fonda-
mentaux de l’insuffisance cardiaque est la
perte cellulaire, que celle-ci soit initiale,
comme cela s’observe lors d’un infarctus du
myocarde, ou qu’elle soit secondaire dans le
cadre du remodelage ventriculaire gauche.
Dans ce cas, il va y avoir une apoptose qui
touchera non seulement la zone nécrosée
mais également les zones initialement non
ischémiques impliquées dans ce remodelage.
Cette perte cellulaire ne peut pas être com-
pensée par une régénération cellulaire. Le
concept de base repose donc sur le point sui-
Entretien
Entretien
Le Courrier de Médecine Vasculaire (2), n° 1, janvier, février, mars 2002
La thérapie cellulaire
de l’insuffisance cardiaque
Interview du Pr Michel Desnos*
Propos recueillis par Joseph Emmerich
L
athérapie cellulaire à
partir de cellules sou-
ches est un sujet d’actualité
en raison des problèmes
éthiques qu’elle soulève,
lorsqu’elle est effectuée à
partir de cellules provenant
d’embryons humains ou
potentiellement de clones.
Dans le domaine de la
pathologie cardiovasculaire,
l’équipe regroupée autour
du Pr Philippe Menasché
(Michel Desnos, Jean-Tho-
mas Villequin, Jean-Pierre
Marolleau, Albert Hagège et
Denis Duboc) est pionnière
sur la thérapie cellulaire de
l’insuffisance cardiaque.
* Service de cardiologie, HEGP.

29
vant : si on peut remettre des cellules contrac-
tiles dans le cœur peut-être pourrait-on amé-
liorer la fonction contractile et donc le
patient.
CMV : Vous dites qu’il n’y a pas de prolifé-
ration cellulaire dans le cœur. Pouvez-vous
donc nous expliquer ce qui se passe lors des
hypertrophies ventriculaires ?
MD : Une des façons du cœur de répondre à
certaines agressions, telles que les surcharges
mécaniques, l’infarctus du myocarde ou
d’autres, est d’entraîner une hypertrophie des
cellules myocardiques qui vont augmenter de
taille, en épaisseur et en longueur, mais elles
ne vont pas se multiplier. Il y a donc dans ces
cas une hypertrophie mais pas d’hyperplasie.
CMV : Donc, en cas d’insuffisance car-
diaque, le cœur manque de cardiomyo-
cytes. Où peut-on trouver des cellules
capables de régénérer le muscle myocar-
dique ?
MD : On sait depuis peu qu’un tout petit
contingent de cardiomyocytes ont une capacité
de régénération, mais malheureusement, ce
phénomène est trop contingent et marginal
pour permettre une régénération efficace ; on
doit donc utiliser d’autres types cellulaires.
Tout d’abord, on peut utiliser des cellules
autologues (provenant du sujet lui-même) ou
des cellules d’autres sujets ou d’embryons.
Dans ces deux derniers cas, cela pose bien
entendu des problèmes de tolérance immuni-
taire et éthiques majeurs, et nous mettrons
donc ces options de côté. Le choix d’utiliser
des cellules provenant du sujet insuffisant
cardiaque requiert l’utilisation de cellules peu
différenciées et d’orienter ensuite leur diffé-
renciation vers une cellule myocardique
contractile, qu’elle ressemble ou non aux
cardiomyocytes. Cela peut se faire théori-
quement à partir des cellules du stroma
médullaire, à partir de cellules cutanées, mais
ce sont des données encore précliniques. Pour
notre part, nous avons privilégié, en raison
d’expérimentations animales préalables,
l’utilisation des cellules satellites musculaires
périphériques, ou myoblastes, qui sont des
cellules souches quiescentes au niveau des
muscles. De plus, ce sont des cellules relati-
vement faciles à cultiver, qui résistent bien à
l’ischémie, et enfin elles sont facilement
accessibles chez l’homme en quantité impor-
tante.
CMV : Cela veut-il dire que l’on prend des
cellules souches initialement à destinée mus-
culaire périphérique et que l’on va orienter
leur différenciation vers d’authentiques car-
diomyocytes ?
MD : Non, justement, on ne transforme pas des
cellules musculaires périphériques en cardio-
myocytes. On prend des myoblastes, que l’on va
cultiver et qui vont se transformer en myotubes,
c’est-à-dire en grandes cellules multinucléées,
contractiles, qui vont, en tout cas nous l’espé-
rons, aider à la contraction du cœur. En aucun
cas ces cellules ne deviennent des cardiomyo-
cytes, mais, en revanche, elles vont acquérir
certains caractères des cardiomyocytes,
notamment en ce qui concerne leur composition
ou phénotype en protéines contractiles.
CMV : Ces cellules ont-elles des connexions
avec les cardiomyocytes natifs, et ces
connexions ne pourraient-elles pas entraîner
des effets secondaires, notamment en favo-
risant la survenue de troubles du rythme par
réentrée, par exemple ?
MD : Le premier élément de réponse concerne
les connexions qui, physiologiquement, ont
lieu entre cardiomyocytes par l’intermédiaire
d’une protéine appelée connexine 43. On
pensait jusqu’ici que cette protéine jouait un
rôle majeur dans ces communications cellu-
laires, mais un travail récent a montré que,
chez des souris invalidées pour cette connexine
43, les animaux survivent et les myocytes se
contractent. Pour notre part, nous n’avons pas
mis en évidence de communications cellu-
laires entre les cellules natives et les cellules
transplantées au travers de la voie de la
connexine 43, mais cela ne veut pas dire que
ces communications en sont absentes. En ce
qui concerne la survenue de troubles du ryth-
me, nous pensions d’ailleurs initialement que
l’absence de connexion au travers de la
connexine 43 pourrait avoir un effet protec-
teur sur la survenue des complications ryth-
miques. En fait, l’expérience clinique, et c’est
évidemment à cela qu’elle sert, nous a donné
tort, puisque sur les 9 premiers malades ayant
été traités par thérapie cellulaire, 4 ont pré-
senté des tachycardies ventriculaires. Ces
troubles du rythme ventriculaires, qui ont
bien répondu aux thérapeutiques habituelles,
posent des questions importantes. Un des
éléments de réponse est que ces troubles du
rythme sont survenus en moyenne 15 jours à
3 semaines après la transplantation cellulaire
Entretien
Entretien

30
et pourraient être secondaires à l’apoptose de
près de 80 % des cellules initialement trans-
plantées. Les arythmies pourraient donc être
une réaction précoce à la réaction inflammatoi-
re et aux remaniements locaux induits initiale-
ment et disparaître ultérieurement. Ces troubles
du rythme initiaux pourraient être un peu
superposables aux manifestations rythmiques
observées à la phase aiguë des myocardites
aiguës et qui disparaissent ensuite. D’ailleurs, il
semble y avoir un parallélisme entre l’impor-
tance du nombre de cellules transplantées et le
risque arythmogène. Dans l’essai de phase 1 de
thérapie cellulaire, qui avait pour but initial
d’évaluer la faisabilité de la technique, les
complications rythmiques ont été les seules
complications observées. Ainsi dans l’essai de
phase 2, qui devrait démarrer au début 2002,
nous avons décidé de prévenir systématiquement
la survenue de ces troubles du rythme par la pres-
cription d’amiodarone et de limiter le nombre
de cellules transplantées à 700 000 cellules.
CMV : Pouvez-vous nous préciser, d’un
point de vue pratique, comment s’effectue
cette transplantation de cellules souches
périphériques, quelles sont, dans l’avenir,
les possibilités que l’on pourrait envisager
autres que chirurgicales, et est-il notamment
envisageable de traiter ces patients par voie
endocavitaire de façon à éviter une chirur-
gie chez ces patients déjà fragiles ?
MD : Du point de vue pratique, le Pr Philippe
Menasché prélève sous anesthésie locale, au
niveau de la cuisse, une dizaine de grammes
de muscle périphérique. Ensuite, l’équipe de
Jean-Thomas Villequin et Jean-Pierre Marolleau,
après dissociation des cellules, les met en
culture de façon à obtenir jusqu’à 500 mil-
lions à un milliard de cellules, en une quin-
zaine de jours. Soulignons que le succès de
notre traitement repose grandement sur cette
expertise dans l’expansion des myoblastes
obtenus par cette équipe. Dans notre étude,
les patients ont été inclus s’ils étaient candi-
dats à une revascularisation coronaire dans un
autre territoire que celui nécrosé pouvant
bénéficier d’une transplantation cellulaire. Il
s’agissait donc d’une chirurgie coronaire
classique avec circulation extracorporelle à
cœur arrêté, et, au cours de cette procédure
sur le territoire préalablement démontré
comme étant non viable, le chirurgien injecte
localement directement en intramusculaire
les cellules par 20 à 30 petites injections. Cela
allonge l’acte chirurgical d’environ 15 minutes.
Il n’y a jamais eu de dilacération du muscle
cardiaque, d’embolies systémiques, d’héma-
tomes ou de perforation du cœur.
CMV : Peut-on envisager pour demain l’in-
jection de ces cellules en dehors d’un acte
de chirurgie conventionnelle ?
MD : Bien sûr, une des limites à l’heure
actuelle est la nécessité d’une chirurgie car-
diaque. Certes, on peut envisager des mini-
thoracotomies, de la chirurgie vidéo-assistée
ou à cœur battant, mais, surtout sur ce terrain,
la morbi-mortalité de la chirurgie restera
toujours un problème. La technique la plus
évaluée est la possibilité d’envisager des
injections endoventriculaires, par ponction
artérielle périphérique et cathétérisme car-
diaque rétrograde. Cela reste néanmoins, à
l’heure actuelle, une technique difficile pour
l’injection intramyocardique en de multiples
points d’une paroi ventriculaire pathologique
et amincie par la fibrose. Par ailleurs, la
seconde grande indication de ces thérapies
cellulaires pourrait être les cardiomyopathies
dilatées non coronariennes, pour lesquelles il
n’y a pas d’indication de revascularisation,
donc de chirurgie, et pour lesquelles l’injec-
tion diffuse intramyocardique par voie intra-
cavitaire avec l’aide d’un mapping du ventri-
cule serait très intéressante. D’autres voies
sont en cours d’évaluation chez l’animal,
péricardique, systémique périphérique et par
injection directe intracoronaire.
CMV : Enfin, pour terminer, il s’agissait
d’un essai de phase 1, donc de faisabilité,
ce que vous avez démontré. Malgré tout,
avez-vous pu déjà objectiver des améliora-
tions de la fonction ventriculaire sur les
zones akinétiques traitées ?
MD : Cet essai de phase 1 n’avait pas pour
rôle d’évaluer une amélioration de la contrac-
tilité ou de l’état clinique des patients, mais
d’étudier la faisabilité et la sécurité de cette
technique. Bien entendu, nous avons regardé
aussi par échocardiographie la cinétique ven-
triculaire. Ainsi, chez certains patients, Albert
Hagège a pu observer un certain degré de
contraction cardiaque, alors qu’avant la pro-
cédure, la paroi était akinétique. L’essai de
phase 2, randomisé, multicentrique et euro-
péen que nous envisageons maintenant aura
pour objectif prioritaire d’évaluer l’évolution
de la cinétique de la zone transplantée par des
cellules musculaires.
Entretien
Entretien
Le Courrier de Médecine Vasculaire (2), n° 1, janvier, février, mars 2002
1
/
3
100%