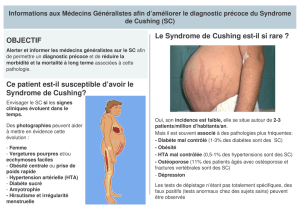
D o s s i e r : ... Le syndrome de Cushing L

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
L
e syndrome de Cushing résulte d’une
sécrétion supraphysiologique chronique
de cortisol qui procède des cellules fasci-
culées et réticulées du cortex surrénalien.
L’hypercorticisme est secondaire, dans 80 à
85 % des cas, à une sécrétion excessive de
corticotropine (ACTH), provenant, le plus
souvent, d’un adénome corticotrope hypo-
physaire (maladie de Cushing) ; plus rare-
ment, elle naît de diverses tumeurs extra-
hypophysaires (sécrétion ectopique d’ACTH),
ou très rarement résulte d’une sécrétion de
corticolibérine (CRH) par des tumeurs non
hypothalamiques (1).
Une étiologie surrénalienne primaire est
impliquée dans environ 15 à 20 % des syn-
dromes de Cushing endogènes. Le cortisol
est sécrété par un adénome ou un carcinome
unilatéral ou, plus rarement, par une hyper-
plasie micronodulaire ou macronodulaire
bilatérale (1). Dans le syndrome de Cushing
surrénalien, la sécrétion excessive de cortisol
entraîne, par rétroaction négative, une
suppression de la synthèse de CRH et
d’ACTH. La régulation de la sécrétion de
cortisol par les tumeurs ou hyperplasies sur-
rénaliennes fut longtemps considérée
comme autonome, puisque l’ACTH est
complètement supprimée. Des études
récentes nous permettent maintenant de
mieux comprendre les mécanismes patho-
physiologiques qui modulent la production
de cortisol et la prolifération cellulaire de
ces lésions dans un sous-groupe de patients.
Des études in vitro ont démontré que
l’adénylcyclase et la stéroïdogenèse pou-
vaient être stimulées par diverses hormones,
autres que la corticotropine, dans des adé-
nomes ou carcinomes surrénaliens (2, 3) ;
la notion de récepteur ectopique (aberrant,
illicite) fut proposée pour expliquer la sté-
roïdogenèse en l’absence d’ACTH (2). Des
études in vivo plus récentes confirment que
la sécrétion de cortisol peut être, chez
certains patients atteints d’hyperplasie
macronodulaire bilatérale ou d’adénomes
unilatéraux, sous le contrôle d’une diversité
d’hormones, dont le récepteur membranaire,
couplé aux protéines G, est exprimé de
façon ectopique et entraîne une stéroïdo-
genèse excessive (3).
120
Dossier : réceptologie
* Service d’endocrinologie et département de médecine, Hôtel-Dieu du centre hospitalier de
l’université de Montréal (CHUM).
Le syndrome de Cushing
surrénalien secondaire a des
récepteurs hormonaux aberrants
I. Bourdeau*, A. Lacroix*
✎La sécrétion de cortisol est normale-
ment régulée par la corticotropine
(ACTH) qui se lie à son récepteur spéci-
fique, ancré dans la membrane des cel-
lules fasciculées et réticulées du cortex
surrénalien, et active la cascade de la
stéroïdogenèse.
✎Le syndrome de Cushing est caractéri-
sé par une production endogène supra-
physiologique de cortisol. Celle-ci est le
plus souvent secondaire à une production
excessive d’ACTH provenant d’un adéno-
me hypophysaire corticotrope (maladie
de Cushing) ou d’une sécrétion tumorale
ectopique. Une hypersécrétion surréna-
lienne primaire de cortisol provenant de
tumeur unilatérale (adénome, carcinome)
ou d’hyperplasie bilatérale (dysplasie
micronodulaire pigmentaire ou hyperpla-
sie macronodulaire) entraînera par rétro-
action négative une suppression de la
production hypophysaire d'ACTH.
✎ Plusieurs équipes ont récemment
démontré que, dans certains cas de syn-
drome de Cushing surrénalien primaire
(adénomes ou hyperplasie macronodu-
laire bilatérale), l’expression surréna-
lienne de récepteurs membranaires ecto-
piques ou l’activité accrue de récepteurs
eutopiques pour des hormones autres
que l’ACTH ont pour conséquence une
régulation aberrante de la sécrétion de
cortisol et autres stéroïdes.
✎Le premier cas clinique rapporté de
régulation aberrante du cortisol a été
celui d’un syndrome de Cushing lié à
l’alimentation résultant de l’expression
surrénalienne ectopique du récepteur du
GIP (gastric inhibitory polypeptide).
✎Les récepteurs surrénaliens aberrants
démontrés actifs in vivo, à ce jour,
incluent ceux du GIP, vasopressine (V1),
bêta-adrénergique, LH/hCG, sérotonine
(5-HT4), et angiotensine (AT-1). Des
études in vitro ont aussi suggéré que
d’autres récepteurs tels que ceux pour
l’interleukine-1, la leptine, l’hormone
thyréotrope (TSH), etc. pourraient aussi
être impliqués.
✎L’expression simultanée de plus d’un
récepteur aberrant a été observée chez
certains patients avec hyperplasie
macronodulaire bilatérale des surrénales
et syndrome de Cushing.
✎L’expression aberrante de récepteurs
hormonaux semble être plus fréquente
dans les hyperplasies macronodulaires
bilatérales que dans les adénomes ou
carcinomes avec syndrome de Cushing.
✎L’expression aberrante de récepteurs
hormonaux peut aussi être retrouvée
dans des cas d’hyperplasie macronodu-
laire bilatérale au stade de sécrétion
subclinique de cortisol sans syndrome de
Cushing franc.
✎La pertinence clinique de la recherche
de récepteurs surrénaliens aberrants
résulte de la possibilité d’utiliser un trai-
tement pharmacologique en évitant une
chirurgie. Ainsi, deux patients atteints de
syndrome de Cushing secondaire à une
hyperplasie surrénalienne macronodulaire
bilatérale, l’un avec récepteurs bêta-
adrénergiques, et l’autre avec récepteurs
LH/hCG et sérotonine, ont été traités
avec succès à long terme en inhibant
pharmacologiquement le récepteur
aberrant.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
Syndrome de Cushing secondaire
à l’expression aberrante
de récepteurs membranaires
surrénaliens
Les premières descriptions cliniques d’un
syndrome de Cushing secondaire à récepteurs
surrénaliens aberrants furent celles de la
sécrétion de cortisol liée à l’alimentation, où
une relation temporelle fut démontrée entre
l’ingestion des repas et la sécrétion de cortisol
(4-6). La sécrétion de cortisol suivait l’aug-
mentation physiologique du GIP (gastric
inhibitory polypeptide ou glucose-depen-
dent insulinotropic peptide) en postprandial,
engendrant une cortisolémie basse à jeun
(ACTH et GIP bas) et une hypercortisolé-
mie après les repas. Puisque le GIP n’induit
pas de sécrétion de cortisol du cortex surré-
nalien normal, il fut proposé que cela résulte
de l’expression surrénalienne ectopique de
récepteurs pour le GIP (5, 6). Le syndrome
de Cushing GIP-dépendant peut survenir
tout autant dans des hyperplasies macrono-
dulaires bilatérales (3, 5-9) que dans des
adénomes unilatéraux (3, 4, 7, 10-12). L’ex-
pression ectopique du récepteur non muté
du GIP a été démontrée par plusieurs
équipes dans le tissu surrénalien GIP-
dépendant (3, 6-13). Lorsque la maladie est
diagnostiquée en début d’évolution, la nature
intermittente de l’hypercorticisme post-
prandial n’engendre qu’une suppression
incomplète de l’ACTH et la cortisolémie à
jeun n’est pas abaissée (14). Récemment,
une sécrétion postprandiale d’androgènes
surrénaliens et de cortisol a été retrouvée
chez une patiente avec hirsutisme, syndrome
de Cushing fruste et un adénome surréna-
lien ; il a été supposé que la cellule initiale
dans laquelle le récepteur du GIP est exprimé
de façon ectopique est localisée dans la
zone réticulée du cortex (zone responsable
de la production des androgènes surréna-
liens) (15).
D’autres récepteurs hormonaux aberrants
ont été identifiés dans le syndrome de
Cushing surrénalien. Le récepteur V1a de la
vasopressine est normalement exprimé dans
le cortex surrénalien, mais n’induit qu’une
stimulation très faible, non perceptible, des
niveaux plasmatiques de cortisol chez l’hu-
main. Il a été démontré que ce récepteur
eutopique (normalement présent) peut être
surexprimé ou être hyperfonctionnel et
engendrer une réponse exagérée en cortisol
à la suite de l’administration exogène de
vasopressine ou pendant des élévations phy-
siologiques, tel l’orthostatisme, chez environ
25 % des cas de Cushing surrénalien (3, 16-
18). L’ expression ectopique de récepteurs
ß-adrénergiques dans le cortex surrénalien
entraîne un syndrome de Cushing, où la
sécrétion de cortisol est augmentée pendant
des élévations physiologiques des catécho-
lamines plasmatiques, telles que celles dues
au stress, à l’orthostatisme ou à l’hypoglycémie
à l’insuline (3, 19). Une patiente avec une
hyperplasie macronodulaire surrénalienne
bilatérale a présenté une symptomatologie
suggestive de syndrome de Cushing transi-
toire durant ses quatre grossesses, mais
l’hypercorticisme clinique et paraclinique
n’est devenu permanent qu’une dizaine
d’années après le début de sa ménopause
(20). La sécrétion de cortisol était stimulée
par l’injection de gonadolibérine (GnRH),
de gonadotropique chorionique (hCG),
d’hormone lutéotrope (LH), mais pas par
celle d’hormone folliculostimulante (FSH).
L’administration orale de deux agonistes du
récepteur 5-HT4de la sérotonine, soit le
cisapride et le métoclopramide, augmentait
également significativement la sécrétion de
cortisol chez cette patiente, suggérant la
fonction aberrante concomitante de récep-
teurs LH/hCG et sérotoninergiques de type
5-HT4. L’hypothèse retenue est qu’une aug-
mentation transitoire des niveaux d’hCG
pendant les grossesses, et une augmentation
permanente de la LH, suivant la ménopause,
ont activé la croissance et la stéroïdogenèse
du cortex surrénalien entraînant le syndrome
de Cushing (3).
Un cas récent de syndrome de Cushing
comportait une hyperplasie macronodulaire
bilatérale, où la sécrétion de cortisol et
d’aldostérone était stimulée par l’orthosta-
tisme et semblait médiée par un récepteur
AT-1 de l’angiotensine (21). Des études in
vitro ont indiqué la stimulation aberrante de
sécrétion de cortisol médiée par des récep-
teurs pour l’interleukine-1 (22) ou la leptine
(9). Finalement, la présence concomitante
de plusieurs récepteurs hormonaux aberrants
a été décrite dans des hyperplasies macrono-
dulaires des surrénales : LH/hCG et séro-
tonine 5-HT4(20),vasopressine-V1a et ß-
adrénergique (23),GIP et leptine (9),
vasopressine-V1a et sérotonine 5-HT4(23),
LH/hCG, sérotonine 5-HT4et vasopressine-
V1a (23),ainsi que, possiblement, LH/hCG
et GIP (24). L’expression d’un ou de plu-
sieurs récepteurs aberrants a aussi été
retrouvée dans des cas d’hyperplasie macro-
nodulaire bilatérale identifiés au moment où
les patients ne présentaient qu’une sécrétion
subclinique de cortisol (cortisolurie dans les
limites de la normale, suppression anormale
par la dexaméthasone) sans signe ni symp-
tôme de syndrome de Cushing (23).
Comment identifier la présence
des récepteurs aberrants ?
Un protocole d’investigation clinique a été
élaboré afin de mettre en évidence la pré-
sence de récepteurs membranaires surréna-
liens aberrants (25). Il est proposé à tous les
patients avec syndrome de Cushing secon-
daire à un adénome unilatéral ou à une
hyperplasie macronodulaire bilatérale. Les
stimulations utilisées en dépistage permet-
tent de rechercher la présence de récepteurs
aberrants qui ont déjà été décrits dans les
études in vitro ou in vivo précédentes (2, 3).
La stratégie consiste à procéder à des stimu-
lations physiologiques et pharmacologiques
de différents ligands. S’il y a des récep-
teurs aberrants couplés à la stéroïdogenèse
dans le cortex surrénalien, ils seront révélés
par la liaison de leurs ligands. Le cortisol
plasmatique et autres stéroïdes ou hormones
pertinentes sont mesurés aux 30-60 minutes
sur une période de 2 à 3 heures (tableau I).
121
Dossier : réceptologie

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
Le test initial est un test de posture qui
consiste en un repos de 60 minutes en supi-
nation, suivi par une période d’ambulation
pendant 2 heures ; cela permet de détecter la
présence possible de récepteurs aberrants
pour l’angiotensine, la vasopressine ou les
catécholamines. Ensuite, le patient ingère
un repas mixte de glucides, lipides et pro-
téines pour évaluer une réponse aberrante
possible à une des hormones gastro-intesti-
nales. La première journée se termine avec
l’administration intraveineuse de 250 µg
d’ACTH 1-24 qui constitue un point de
référence de la stéroïdogenèse maximale de
la masse tumorale surrénalienne. Au cours
d’une autre journée, 100 µg de GnRH sont
administrés i.v. et évaluent la présence
potentielle de récepteurs aberrants pour la
FSH, la LH/hCG et la GnRH. Cela est suivi
par un bolus i.v. de 200 µg de TRH pour
évaluer la présence de récepteurs aberrants
pour la TSH, la prolactine ou la TRH. Lors
du troisième jour, l’administration séquen-
tielle de glucagon (1mg i.v.), d’arginine-
vasopressine (10 UI i.m.) et de 10 mg de
métoclopramide par voie orale permet
d’évaluer la fonction aberrante de récep-
teurs pour le glucagon, la vasopressine (V1,
V2 ou V3) ou la sérotonine (5-HT4).
Nous avons défini empiriquement qu’un
changement de la cortisolémie de moins de
25 % représente une absence de réponse, de
25 à 49 %, une réponse partielle et de plus
de 50 %, une réponse significative. Si une
réponse partielle ou positive est retrouvée,
le test est répété afin de vérifier la reproduc-
tibilité de la réponse et pour déterminer si
les autres stéroïdes comme l’aldostérone, le
DHEAS, la testostérone et l’estradiol sont
aussi modifiés ; de plus, les fluctuations des
ligands hormonaux potentiellement impli-
qués sont déterminées (catécholamines,
vasopressine, et rénine/angiotensine-II
durant la posture). Si la réponse initiale
pouvait impliquer plusieurs ligands simulta-
nément, d’autres investigations spécifiques
sont effectuées afin d’identifier précisément
le ou les ligands impliqués (tableau II).
Chez qui doit-on rechercher la
présence de récepteurs
surrénaliens anormaux ?
Des études prospectives systématiques ont
démontré que la présence de récepteurs hor-
monaux aberrants surrénaliens est prévalente
chez les patients avec hyperplasie macrono-
dulaire des surrénales (23, 26). Des études
furent réalisées chez douze patients atteints
d’hyperplasie macronodulaire bilatérale,
incluant six patients avec syndrome de
Cushing franc et six avec sécrétion subcli-
nique de cortisol ; la présence d’au moins
un récepteur aberrant a été démontrée in
vivo chez tous les patients dépistés (23, 26).
Les six patients présentant un syndrome de
Cushing subclinique étaient référés pour
incidentalomes surrénaliens bilatéraux. Ils
présentaient des cortisoluries normales, une
suppression anormale aux tests à la dexamé-
thasone et des niveaux d’ACTH plasma-
tique partiellement abaissés. Des treize
patients évalués avec syndrome de Cushing
secondaire à un adénome surrénalien unila-
122
Dossier : réceptologie
Stimulations Inhibition / Ligands Récepteurs aberrants
Physiologiques Pharmacologiques absence de réponse
repas infusion de GIP somatostatine GIP GIP
glucose IV
stress hypoglycémie inhibition par les catécholamines β-adrénergiques
insulinique β-bloqueurs
orthostation infusion d’isoprotérénol
grossesse administration de pas de réponse à FSH hCG placentaire
GnRH, hCG, LH
ménopause inhibition à long terme
par des agonistes GnRH LH LH/hCG
orthostation vasopressine exogène inhibition par une vasopressine vasopressine V1
surcharge en eau
déshydratation infusion de salin pas de réponse à
hypertonique la desmopressine
vasopressine inhibition par des
endogène antagonistes V1 de
la vasopressine
inconnu cisapride, sérotonine sérotoninergiques de
métoclopramide type 4 (5-HT4)
Tableau II. Stratégie d'investigation complémentaire pour la caractérisation des récepteurs surrénaliens
aberrants.
Temps Jour 1 Jour 2 Jour 3
(minutes)
-60 À jeun À jeun À jeun
couché couché couché
-15 * * *
0Debout* GnRH Glucagon
100 µg i.v.* 1mg i.v.*
30 Debout* * *
60 Debout* * *
90 Debout* * *
120 Debout* * *
150 Couché*
180 Repas mixte* Vasopressine
10 UI i.m.*
210 * *
240 * *
270 * * *
300 * TRH *
200 µg i.v.*
330 *
360 ACTH *
Métoclopramide
250 µg i.v.* 10 mg p.o.
390 * * *
420 * * *
450 * *
480 * *
Tableau I. Protocole de dépistage initial de la
présence de récepteurs surrénaliens aberrants.
*Prélèvements sanguins pour cortisolémie, ACTH, autres
hormones et signes vitaux.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
téral, seulement trois présentaient des
réponses partielles aux différentes stimula-
tions (26). Des résultats semblables ont été
récemment présentés par une autre équipe
qui a démontré la présence de récepteurs
aberrants chez cinq patients avec hyperplasie
macronodulaire bilatérale et syndrome de
Cushing (24). Bien que moins prévalente, la
présence de récepteurs aberrants pour la
vasopressine, le GIP et la LH a été rap-
portée dans des cas de syndrome de
Cushing avec adénome unilatéral (3, 18). Il
est certain que des mécanismes autres que
celui des récepteurs hormonaux aberrants
sont impliqués dans la pathophysiologie des
tumeurs surrénaliennes sécrétant du cortisol,
tels que des altérations de la voie de signali-
sation de l’AMP cyclique (protéines G,
PKA, CREB), des oncogènes et des anti-
oncogènes (27-29).
Traitement pharmacologique
potentiel
L’identification de récepteurs surrénaliens
aberrants chez des patients avec syndrome
de Cushing ACTH-indépendant peut, dans
certains cas, permettre l’utilisation d’un
traitement pharmacologique en alternative à
la chirurgie. Le traitement médical est d’autant
plus intéressant lorsque l’atteinte surréna-
lienne est bilatérale, puisque son efficacité
pourrait éviter la surrénalectomie bilatérale
et les risques inhérents à une insuffisance
surrénalienne définitive. Le traitement a
pour objectif soit d’inhiber la production du
ligand, soit de bloquer l’activation du récep-
teur aberrant. Dans les cas de syndrome de
Cushing GIP-dépendant, de l’inhibition de
la sécrétion de GIP par l’administration
chronique d’octréotide, il a résulté une amé-
lioration clinique et biochimique pendant
quelques semaines chez certains patients (6,
10) ; cependant, une absence d’efficacité
de l’octréotide a nécessité le recours à
une surrénalectomie. L’administration de
propranolol, un ß-bloquant, a permis de
normaliser à long terme la sécrétion de cor-
tisol d’un patient avec hyperplasie macrono-
dulaire des surrénales et syndrome de
Cushing secondaire à l’expression de récep-
teurs β-adrénergiques aberrants (19).
L’administration répétée toutes les quatre
semaines de la forme dépôt d’acétate de leu-
prolide a maintenu les niveaux de cortisol
urinaire dans les limites de la normale chez
la patiente atteinte d’un syndrome de
Cushing LH-dépendant (20). Elle a récupéré
un axe hypothalamo-hypophyso-surrénalien
normal en une période de six mois suivant
le début du traitement. Chez les deux patients
que nous venons d’évoquer, le syndrome de
Cushing clinique a disparu, mais la taille
radiologique des surrénales n’a pas régressé
deux à quatre ans après l’amorce du traite-
ment. La stabilité de la taille des surrénales
peut s’expliquer par le fait que des doses
minimales de propranolol étaient requises
pour normaliser les cortisoluries, ne blo-
quant ainsi que partiellement les récepteurs
aberrants ; des doses plus élevées ont induit
un hypocorticisme. L’acétate de leuprolide a
inhibé complètement la production de LH,
mais la présence de récepteurs sérotonine 5-
HT4concomitante est possiblement respon-
sable du maintien de l’hyperplasie macrono-
dulaire. Bien que le rôle des récepteurs
aberrants sur la stéroïdogenèse anormale
soit maintenant bien démontré, son rôle sur
la croissance tumorale reste à élucider. Fina-
lement, le développement pharmacologique
de nouveaux antagonistes de ligands ou de
récepteurs aberrants laisse entrevoir de nou-
velles avenues thérapeutiques (tableau III).
Conclusion
Le syndrome de Cushing demeure une
maladie rare et complexe autant dans son
investigation que ses traitements. Le
concept de régulation anormale du cortisol
par des récepteurs aberrants dans ses étiolo-
gies surrénaliennes primaires (adénome,
hyperplasie macronodulaire) n’a été démon-
tré qu’au cours des dix dernières années et
est certainement encore sous-diagnostiqué.
Nous suggérons que le dépistage systéma-
tique, in vivo, de la présence de récepteurs
aberrants soit réalisé chez tous les patients
avec une hyperplasie macronodulaire bilaté-
rale des surrénales, et soit considéré dans
les cas d’adénomes surrénaliens avec syn-
drome de Cushing.
Plusieurs aspects moléculaires et génétiques
restent à explorer dans la compréhension de
la tumorigenèse des lésions surrénaliennes
associées à l’expression aberrante de récep-
teurs hormonaux (3). Ces progrès, couplés
au développement de nouvelles molécules
capables d’inhiber de façon sélective les
récepteurs hormonaux impliqués, laissent
entrevoir des perspectives intéressantes pour
le traitement du syndrome de Cushing
surrénalien.
Références
1.
Nieman LK. Cushing’s syndrome. In : De
Groot LJ, Jameson JL, Burger HG et al.
Endocrinology. Philadephia : W. B. Saunders Co
(4eéd.) 2001 : 1691-720.
123
Dossier : réceptologie
Récepteurs aberrants Traitement pharmacologique potentiel
GIP somatostatine
β-adrénergiques β-bloqueurs
TSH L-thyroxine
LH/hCG analogue GnRH
Vasopressine V1 antagoniste V1-vasopressine
Sérotoninergiques de type 5-HT4antagoniste sérotonine 5-HT4
Angiotensine-II antagoniste AT-1
Tableau III. Traitement pharmacologique potentiel du syndrome de Cushing associé à des récepteurs
surrénaliens aberrants.

Act. Méd. Int. - Métabolismes - Hormones - Nutrition, Volume VI, n° 3, mai-juin 2002
2.
Hingshaw HT, Ney RL. Abnormal control in
the neoplastic adrenal cortex. In : McKerns KW.
Hormones and Cancer. New York : Academic
Press, 1974 : 309-27.
3.
Lacroix A, N’Diaye N, Tremblay J, Hamet P.
Ectopic and abnormal hormone receptors in
adrenal Cushing’s syndrome. Endocr Rev 2001 ;
22 : 75-110.
4.
Hamet P, Larochelle P, Franks DJ et al.
Cushing syndrome with food-dependent periodic
hormonogenesis. Clin Invest Med 1987 ; 10 :
530-3.
5.
Lacroix A, Bolte E, Tremblay J et al. Gastric
inhibitory polypeptide-dependent cortisol
hypersecretion : a new cause of Cushing’s syn-
drome. N Engl J Med 1992 ; 327 : 974-80.
6.
Reznik Y, Allali-Zerah V, Chayvialle JA et al.
Food-dependent Cushing’s syndrome mediated
by aberrant adrenal sensitivity to gastric
inhibitory polypeptide. N Engl J Med 1992 ; 327 :
981-6.
7.
Lebrethon MC, Avallet O, Reznik Y et al.
Food-dependent Cushing’s syndrome : character-
ization and functional role of gastric inhibitory
polypeptide receptor in the adrenals of three
patients. J Clin Endocrinol Metab 1998 ; 83 :
4514-9.
8.
N’Diaye N, Hamet P, Tremblay J et al.
Asynchronous development of bilateral nodular
adrenal hyperplasia in gastric inhibitory
polypeptide-dependent Cushing’s syndrome.
J Clin Endocrinol Metab 1999 ; 84 : 2616-22.
9.
Pralong FP, Gomez F, Guillou L et al. Food-
dependent Cushing’s syndrome : possible
involvement of leptin in cortisol hypersecretion.
J Clin Endocrinol Metab 1999 ; 84 : 3817-22.
10.
De Herder WW, Hofland LJ, Usdin TB et al.
Food-dependent Cushing’s syndrome resulting
from abundant expression of gastric inhibitory
polypeptide receptors in adrenal adenoma cells.
J Clin Endocrinol Metab 1996 ; 81 : 3168-72.
11.
Chabre O, Liakos P, Vivier J et al. Cushing’s
syndrome due to a gastric inhibitory polypep-
tide-dependent adrenal adenoma : insights into
hormonal control of adrenocortical tumorigene-
sis. J Clin Endocrinol Metab 1998 ; 83 : 3134-43.
12.
N’Diaye N, Tremblay J, Hamet P et al.
Adrenocortical overexpression of gastric
inhibitory polypeptide receptor underlies food-
dependent Cushing’s syndrome. J Clin
Endocrinol Metab 1998 ; 83 : 2781-5.
13.
Gerl H, Rohde W, Biering H et al.
Nahrungsabhängiges Cushing-Syndrom mit
langer Anamnese und moderater Klinik.
Deutsch Med Wschr 2000 ; 125 : 1565-8
14.
Croughs RJ, Zelissen PM, Van Vroonhoven
TJ et al. GIP-dependent adrenal Cushing’s syn-
drome with incomplete suppression of ACTH.
Clin Endocrinol (Oxf) 2000 ; 52 : 235-40.
15.
Tsagarakis S, Tsigos C, Vassiliou V et al.
Food-dependent androgen and cortisol secretion
by a gastric inhibitory polypeptide-receptor
expressive adrenocortical adenoma leading to
hirsutism and subclinical Cushing’s syndrome :
in vivo and in vitro studies. J Clin Endocrinol
Metab 2001 ; 86 : 583-9.
16.
Perraudin V, Delarue C, de Keyzer Y et al.
Vasopressin-responsive adrenocortical tumor in
a mild Cushing’s syndrome : in vivo and in vitro
studies. J Clin Endocrinol Metab 1995 ; 80 :
2661-7.
17.
Lacroix A, Tremblay J, Touyz RM et al.
Abnormal adrenal and vascular responses to
vasopressin mediated by a V1-vasopressin
receptor in a patient with adrenocorticotropin-
independent macronodular adrenal hyperplasia,
Cushing’s syndrome, and orthostatic hypoten-
sion. J Clin Endocrinol Metab 1997 ; 82 : 2414-22.
18.
Arnaldi G, Gasc JM, de Keyzer Y et al.
Variable expression of the V1 vasopressin recep-
tor modulates the phenotypic response of
steroid-secreting adrenocortical tumors. J Clin
Endocrinol Metab 1998 ; 83 : 2029-35.
19.
Lacroix A, Tremblay J, Rousseau G et al.
Propranolol therapy for ectopic beta-adrenergic
receptors in adrenal Cushing’s syndrome.
N Engl J Med 1997 ; 337 : 1429-34.
20.
Lacroix A, Hamet P, Boutin JM. Leuprolide
acetate therapy in luteinizing hormone-depen-
dent Cushing’s syndrome. N Engl J Med 1999 ;
341 : 1577-81.
21.
Nakamura Y, Son Y, Kohno Y et al. Case
of adrenocorticotropic hormone-independent
macronodular adrenal hyperplasia with possible
adrenal hypersensitivity to angiotensin II.
Endocrine 2001 ; 15 : 57-61.
22.
Willenberg HS, Stratakis CA, Marx C et al.
Aberrant interleukin-1 receptors in a cortisol-
secreting adrenal adenoma causing Cushing’s
syndrome. N Engl J Med 1998 ; 339 : 27-31.
23.
Mircescu H, Jilwan J, N’Diaye N et al. Are
ectopic or abnormal membrane hormone recep-
tors frequently present in adrenal Cushing’s syn-
drome ? J Clin Endocrinol Metab 2000 ; 85 :
3531-6.
24.
Bourdeau I, D’Amour P, Hamet P et al.
Aberrant membrane hormone receptors in inci-
dentally discovered bilateral macronodular
adrenal hyperplasia with subclinical Cushing’s
syndrome. J Clin Endocrinol Metab 2001 ; 86 :
5534-40.
25.
Bertherat J, Barrande G, Lefebvre H et al.
Systematic screening confirms that illicit mem-
brane receptors are frequent and often multiple
in bilateral ACTH-independent macronodular
adrenal hyperplasia (AIMAH). Program and
Abstracts of The Endocrine Society’s 83rd
Annual Meeting, Denver, Colorado 2001 ;
Abstract P1-397 : 233.
26.
Lacroix A, Mircescu H, Hamet P. Clinical
Evaluation of the presence of abnormal hor-
mone receptors in adrenal Cushing’s syndrome.
The Endocrinologist 1999 ; 9 : 9-15.
27.
Weinstein LS, Shenker A, Gejman PV et al.
Activating mutations of the stimulatory G pro-
tein in the McCune-Albright syndrome. N Engl J
Med 1991 ; 325 : 1688-95.
28.
Kirschner LS, Carney JA, Pack SD et al.
Mutations of the gene encoding the protein
kinase A type I-alpha regulatory subunit in
patients with the Carney complex. Nat Genet
2000 ; 26 : 89-92.
29.
Gicquel C, Bertherat J, Le Bouc Y, Bertagna X.
Pathogenesis of adrenocortical incidentalomas
and genetic syndromes associated with adreno-
cortical neoplasms. Endocrinol Metab Clin
North Am 2000 ; 29 : 1-13.
124
Dossier : réceptologie
1. Vrai ou faux ?
Les récepteurs surrénaliens aberrants
sont impliqués dans la physiopatho-
logie de la maldie de Cushing.
2. Vrai ou faux ?
Le syndrome de Cushing dépendant
de l’alimentation peut entraîner une
cortisolémie basse le matin à jeun.
3. Vrai ou faux ?
Les récepteurs surrénaliens aberrants
sont retrouvés plus fréquemment
dans les adénomes que dans l’hyper-
plasie macronodulaire bilatérale des
surrénales.
4. Vrai ou faux ?
La présence de certains récepteurs
surrénaliens aberrants permet parfois
de traiter le syndrome de Cushing en
inhibant pharmacologiquement le
récepteur aberrant de façon transi-
toire ; cependant, aucun patient n’a
pu bénéficier d’un traitement phar-
macologique à long terme.
Résultats : 1. Faux 2. Vrai 3. Faux 4. Faux
aut
auto-t
o-test
est
1
/
5
100%