roneo 10 10

UE3$Pr$Hestin$ $ Physiopathologie$
Mercredi$10$octobre$2012$ $ de$8h$à$9h$
$
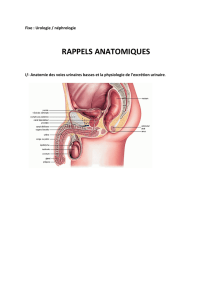
Physiopathologies-de-la-formation-des-œdèmes-
A la fin du cours il faut connaitre :
• Le rôle des forces de Starling dans les mouvements de l’eau entre l’espace
plasmatique et l’espace interstitiel.
• Le rôle central de la rétention rénale de sodium dans le développement d’œdèmes
cliniquement décelables.
• Les différents facteurs qui contribuent à la formation des œdèmes dans les principaux
états œdémateux généralisés :
o Insuffisance cardiaque congestive
o La cirrhose hépatique avec ascite
o Le syndrome néphrotique
• Les mécanismes d’action des diurétiques.
I. Comment se forment les œdèmes ?
1. Mécanismes
C’est toujours par la loi de Starling :
La pression oncotique à l’intérieur du vaisseau tend à retenir le liquide dans le vaisseau.
Il existe un différentiel de 20mmHg pour cette pression. La pression hydrostatique, qui pousse
le liquide vers l’extérieur, est en moyenne de 20,5mmHg. Cette différence entre les 2
pressions traduit une légère tendance de fuite liquidienne vers l’extérieur.
Les mécanismes responsables de l’extravasation de liquide de l’intérieur vers l’extérieur sont :
> Une pression hydrostatique capillaire augmentée.
> Une pression oncotique capillaire diminuée.
> Une perméabilité augmentée de la membrane capillaire (cf. dans les œdèmes de
quick, allergique ou le capillaire est complétement perméable au liquide sans qu’il
y ait de pression.)
> Une obstruction lymphatique avec en amont une augmentation de la pression par
exemple par des cellules néoplasiques malignes.
Les forces gouvernant l’échange liquidien à travers la membrane capillaire, sont la pression
hydrostatique différentielle de 20,5 mm Hg sortant le liquide de l’espace vasculaire et la
pression oncotique différentielle de 20 mm Hg attirant le liquide dans l’espace vasculaire.
Le schéma représentant les échanges de liquides entre les compartiments plasmatiques et
liquidiens montre que la pression hydrostatique est à l’origine du déplacement vers le liquide

UE3$Pr$Hestin$ $ Physiopathologie$
Mercredi$10$octobre$2012$ $ de$8h$à$9h$
$
interstitiel. Tandis que la pression oncotique permet au liquide d’aller dans le plasma, tout
comme les lymphatiques.
2. Les causes médicales :
En cas d’insuffisance cardiaque le cœur a du mal à pomper, en aval intervient une
diminution pression systolique, alors qu’au contraire, en amont, c’est une augmentation de la
pression hydrostatique capillaire qui peut entrainer un OAP (en cas IC gauche uniquement).
Si c’est une IC droite cela engendre une augmentation de la pression hydrostatique, le retour
veineux ne se fait pas bien (blocage du cœur), du coup on observe une fuite du liquide dans le
sens plasmas interstitiel.
En cas d’insuffisance hépatique, (ou de dénutrition) il se produit une diminution de la
synthèse d’albumine conduisant à une hypo-albuminémie. S’en suit une diminution de la
pression oncotique capillaire, qui provoque une fuite de liquide plasmatique vers l’interstitium
avec une augmentation du volume interstitiel, d’où œdèmes.
Dans le syndrome néphrotique, il peut y avoir une perte importante d’albumine par le passage
de la protéine à travers la membrane, conduisant aussi à une hypo albuminémie. On se
retrouve dans la même situation que précédemment.
Cette fuite du plasma vers l’interstitium avec apparition d’œdème conduit à une hypovolémie
relative. En effet il n’y a plus assez de liquide plasmatique, tous les organes sont moins bien
perfusés, cela peut même être a l’origine d’une insuffisance rénale fonctionnelle… Cette
hypovolémie relative entraine une contraction du volume extra cellulaire entrainant des
mécanismes compensateurs, étant la réabsorption d’eau et de sodium, qui vont aggraver les
œdèmes. Ces réabsorptions ne vont pas rester dans les vaisseaux dû au phénomène de fuite,
donc ces mécanismes compensateurs vont pérenniser cette fuite.
II. La rétention rénale d’eau et de sel :
1. Différents cas :
Si l’on prend les cas suivants, ils sont les plus représentatifs de la formation d’œdème :
• l’insuffisance cardiaque congestive,
• la cirrhose hépatique,
• le syndrome néphrotique.
Le déséquilibre de la loi de Starling, entraine un déplacement du liquide plasmatique vers le
liquide interstitiel, mais sans augmentation du volume totale. En situation de rétention rénale,
on a un changement de distribution des volumes entre les différents compartiments ainsi
qu’une augmentation de ce volume. (On passe de 14L à 15L).

UE3$Pr$Hestin$ $ Physiopathologie$
Mercredi$10$octobre$2012$ $ de$8h$à$9h$
$
En effet le déséquilibre des forces de Starling déplace le plasma vers le compartiment
interstitiel. Le volume plasmatique efficace diminue et ainsi la contraction du volume
plasmatique entraine :
> Une stimulation du SRAA
> Et une accélération de la réabsorption rénale d’eau et de NaCl.
Mais on peut aussi avoir la formation d’un œdème généralisé, l’incapacité des reins à excréter
l’eau et le NaCl est responsable de l’expansion du volume des liquides interstitiels et
extracellulaires.
Le rein continue malgré tout à réabsorber de l’eau et du sel parce qu’il est sensible à
l’hypovolémie.
2. Mécanismes :
La rétention primitive (c'est-à-dire sans mécanisme compensateur) est surtout vue dans les cas
d’insuffisance rénale chronique avancée où le rein n’est plus capable d’excréter l’eau et le sel,
à cause des anomalies des parois tubulaires.
La réponse compensatrice à la diminution du volume circulant efficace
Dans le cas d’une IC congestive, on observe une compensation adaptée à la diminution du
volume circulant efficace. Le rein perçoit une hypovolémie et donc réagit en réabsorbant du
sel et de l’eau pour rétablir un volume plasmatique normal.
L’hypovolémie conduit à :
> Une augmentation du SRAA qui comprend :
• de la rénine (due à la fois à la perception par une cellule de la macula
densa de très peu d’NaCl éliminé, et aussi par les cellules à rénine
dans les vaisseaux qui sont des barorécepteurs sensibles aux variations
de volume),
• de l’angiotensine II (réabsorption au niveau du Tube Proximal),
• de l’aldostérone (réabsorption dans le Tube collecteur et qui est
réactif au Récepteur volémique)
> Une augmentation de la noradrénaline par une stimulation du système nerveux
sympathique
> Une augmentation de l’ADH stimulé par la sensation de soif, elle entraine la
réabsorption d’eau au niveau du tube collecteur.
En conséquence on aura:
> Une diminution de DFG
> Une augmentation de la réabsorption proximale de sodium (noradrénaline –
angiotensine II)

UE3$Pr$Hestin$ $ Physiopathologie$
Mercredi$10$octobre$2012$ $ de$8h$à$9h$
$
> Une augmentation de la réabsorption de Na+ et d’eau dans le tube collecteur
(aldostérone ADH)
III. Les principaux états œdémateux généralisés :
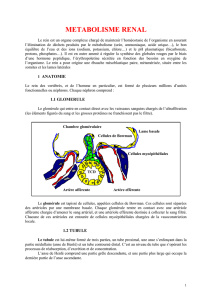
1. Le syndrome néphrotique :
Il s’agit d’une augmentation de la perméabilité glomérulaire qui permet une fuite urinaire de
l’albumine.
Elle est caractérisée par :
- protéinurie ˂ 3g/24h,
- hypo albuminémie ˂ 30g/L,
- œdèmes (pas obligatoire dans la définition du syndrome, parfois il peut y
avoir un authentique syndrome néphrotique sans œdème).
En clinique on peut observer une prise de poids, une infiltration dans les séreuses (plèvre –
péricarde) et des œdèmes blancs mais indolores pendant le godet. Ces œdèmes sont
particulièrement présents aux parties déclives (par exemple les jambes en fin de journée).
L’épanchement des séreuses n’est pas inflammatoire c’est uniquement de l’eau et du sel, et il
peut conduire à une péricardite ou épanchement pleural.
Le syndrome néphrotique pur correspond à une néphrose lipoïdique ou à des glomérules
optiquement normaux en particulier chez l’enfant. Ils répondent généralement très bien après
une corticothérapie pour les enfants surtout. Ils sont dits purs car il n’y a pas d’insuffisance
rénale, ni d’hypertension artérielle, et pas non plus d’hématurie macroscopique (mais
hématurie microscopique c’est une protéinurie isolée)
Mais un très bon critère est la sélectivité de la protéinurie : plus il y a d’albumine meilleur
sera l’indice de corticosensibilité, qui va être détectée par une électrophorèse des protéines
urinaires. Dans ce cas, il y a de grandes chances que la corticothérapie soit efficace.
2. Insuffisance cardiaque congestive
Elle peut être du à une cardiomyopathie ischémique mais aussi des pathologies valvulaires. La
pompe n’est plus aussi efficace, d’où l’augmentation de la pression hydrostatique capillaire en
amont qui provoque des œdèmes dus à une élévation de la pression veineuse.
On peut distinguer 2 mécanismes différents pour un OAP dû à un infarctus :
> soit par augmentation brutale dans la pression de l’oreille gauche,
> soit par une augmentation de la pression dans les capillaires pulmonaires au niveau
de la membrane alvéolaire.

UE3$Pr$Hestin$ $ Physiopathologie$
Mercredi$10$octobre$2012$ $ de$8h$à$9h$
$
Cas clinique : Les œdèmes d’obstruction :
En cas d’infarctus myocardique avec baisse du débit cardiaque brutal.
1. quelles sont les conséquences au niveau de :
a. La perfusion rénale
b. Du débit sanguin rénal
c. Quels sont les mécanismes compensateurs mis en œuvre ? stimulation
SRAA, système sympathique, avec réabsorption du sodium pour compenser
l’état d’hypovolémie relative. En plus vasoconstriction artériolaires
2. Quelles sont les conséquences prévisibles au niveau de la fonction rénale ?
3. Caractéristique de la fonction rénale. La fonction rénale sera altérée, une insuffisance
rénale un peu sévère de cause pré rénale et donc semble à priori réversible. (il ya 3
types qui seront revus ultérieurement)
4. Quelle est l’excrétion urinaire attendue ? la natriurèse sera effondrée et taux
d’excrétion rénale du sodium sera inférieur à 1%. Tout en gardant un état
hémodynamique normal.
Attention : Ne surtout pas mettre de diurétique, cela aggraverait la situation.
3. Physiopathologie des œdèmes en cas d’ICC et de cirrhose.
Dans le cas d’une ICC avec :
> Une obstruction veineuse avec augmentation de la P hydrostatique de retour
> Une diminution pression systolique moyenne
> Si le débit sanguin rénal et la filtration rénale sont altérés.
On peut noter la mise en jeu des mécanismes compensateurs (stimulation du SRAA), une
augmentation d’ADH, une augmentation de toutes les substances vasoconstrictrices
(catécholamines, noradrénaline, épinéphrine). Tout cela provoquant une augmentation de la
réabsorption d’eau et de sel.
La cirrhose montre :
> Une insuffisance hépatique qui entraine la diminution de la synthèse des protéines
> Un bloc hépatique avec une augmentation de la pression veineuse hydrostatique
dans le système veineux porte conduisant à une ASCITE
> cette ascite qui contribue à la constitution du 3ème secteur entrainant une
hypovolémie et une diminution de la perfusion rénale.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%