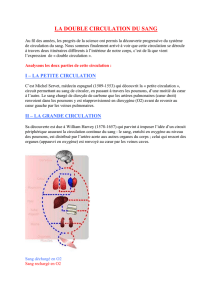
La structure et la fonction du poumon

INT J TUBERC LUNG DIS 14(4):391–396
© 2010 The Union REVUE GENERALE
[Traduction de l’article : « The structure and function of the lung » Int J Tuberc Lung Dis 2010; 14(4): 391–396]
2010 L’ANNEE DU POUMON
Editeur de la série: John F. Murray
La structure et la fonction du poumon
John F. Murray
Professor Emeritus of Medicine, University of California, San Francisco, California, États-Unis
Auteur pour correspondance : John F Murray, MD, FRCP, International Union Against Tuberculosis and Lung Disease,
68 boulevard Saint-Michel, 75006 Paris, France. Tel : (+33) 1 44 32 03 60. e-mail : [email protected]
Comme je l’ai dit dans mon éditorial introductif dans le numéro de janvier du
Journal, les objectifs spéci ques de la campagne de 2010: Année du Poumon
sont « éveiller la conscience du public au sujet de la santé pulmonaire, com-
mencer des actions dans les collectivités au niveau mondial et plaider pour
des ressources destinées à combattre les maladies pulmonaires, y compris les
ressources pour la recherche et des programmes de formation à la recherche
au niveau mondial ». L’offensive vise avec insistance à améliorer la préven-
tion et à renforcer la prise en charge des nombreuses maladies pulmonaires
qui compliquent et raccourcissent d’innombrables millions de vies humaines
chaque année.
Mais elle inclut également « la prise de conscience au sujet de la santé
pulmonaire » qui à mon avis comporte une certaine connaissance sur la façon
dont les poumons des gens fonctionnent effectivement. A quoi ressemblent-ils ?
Pourquoi sont-ils si particuliers ? Ici, vous trouverez donc une vue des pou-
mons humains sains par l’intérieur pour illustrer leur parfaite structuration en
vue de leur fonction principale : l’apport complet d’oxygène à notre corps et
l’élimination du dioxide de carbone indésirable pendant toute la vie.
J F. M, Editeur de la Série
e-mail : [email protected]
LORSQU’ILS SONT REMPLIS de leur volume habi-
tuel d’oxygène, de dioxyde de carbone et des gaz ac-
compagnants, les deux poumons prennent plus de
place dans le corps humain que n’importe quel autre
organe. Mais notre « plus grand organe » est composé
d’environ seulement un demi-litre de tissu et d’environ
la même quantité de sang : tout le reste, c’est de l’air
—approximativement 4,3 litres dans le modèle repris
pour cet article: celui d’un homme âgé de 30 ans, bien
portant, d’une taille de 1,75 m et d’un poids de 70 kg.
(La taille des poumons varie considérablement en
fonction de l’âge, du sexe, de la taille et de l’ethnie.)
A première vue, les proportions étonnamment diffé-
rentes des tissus et du sang par rapport à l’air peuvent
paraître disproportionnées, mais comme nous le mon-
trons dans cet article, la structure anatomique des
poumons correspond élégamment à leur fonction
physiologique principale : l’absorption d’oxygène,
l’élimination du dioxyde de carbone, un point sou-
ligné récemment dans une analyse téléologique de la
structure du poumon par Ewald Weibel,1 qui a géné-
reusement mis à disposition plusieurs illustrations
pour cette revue.
La structure des poumons ne change pas avec la
position du corps, mais sa fonction le fait ; dans les
discussions qui suivent, je vais décrire comment les
poumons adultes sains fonctionnent lorsque le corps
est vertical, assis, debout ou à la marche. Ensuite pour
illustrer l’importance clinique des relations structure-
fonction qui gouvernent le comportement des pou-
mons humains, je conclurai par quelques brefs com-
mentaires sur la façon dont cette interdépendance
explique certaines observations courantes au sujet de
la tuberculose pulmonaire (TB).
Les articles précédents de cette série Éditorial: Murray J F. 2010: The
Year of the Lung. Int J Tuberc Lung Dis 2010; 14(1): 1– 4. Éditorial:
Castro K G, Bell B P, Schuchat A. Preventing complications from
2009 infl uenza A (H1N1) in persons with underlying lung diseases:
a formidable challenge for 2010 Year of the Lung. Int J Tuberc
Lung Dis 2010; 14(2): 127–129. Éditorial: Barker K. Canadian First
Nations experience with H1N1: new lessons or perennial issues?
Int J Tuberc Lung Dis 2010; 14(2): 130. Unresolved issues: Lalloo,
U G. Drug-resistant tuberculosis: reality and potential threat. Int
J T uberc Lung Dis 2010; 14(3): 255–258.

2 The International Journal of Tuberculosis and Lung Disease
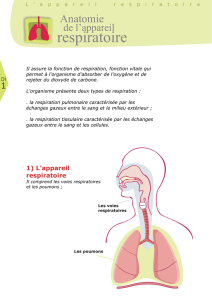
VOIES AERIENNES
Une bonne façon de débuter, c’est par l’entrée du cou-
rant aérien dans les poumons : la trachée qui com-
mence au niveau du larynx à la partie supérieure du
cou, descend vers le bas au travers du dé lé thora-
cique jusqu’au bord supérieur de la cinquième vertèbre
dorsale où elle se divise dans les deux bronches prin-
cipales, une pour chaque poumon. Les deux bronches
principales se divisent alors en différentes branches
caractéristiques qui divisent le poumon gauche et le
poumon droit en con gurations anatomiques habi-
tuelles lobaires et segmentaires. Toutes les bronches
proximales relativement grandes, environ jusqu’au
niveau sous-segmentaire, se dénomment bronches :
par dé nition, leurs parois contiennent des cartilages
et des glandes à mucus. Bien peu après, les bronches
se métamorphosent en bronchioles dont le calibre est
plus étroit (< 2 mm) ; ce sont des voies respiratoires
à paroi membraneuse où cartilage et glandes font
défaut.
Les bronches et les bronchioles se divisent habi-
tuellement en deux branches lles qui diffèrent par la
taille et par l’angulation (Figure 1). La branche des-
servant les unités d’échange gazeux dans la région
distale du poumon est plus axiale et a une surface de
section plus grande que la branche plus petite et à
angle plus aigu qui conduit aux unités proximales
d’échange gazeux. La Figure montre également qu’en
raison de leur inertie inhérente, les particules se trou-
vant dans le courant gazeux d’entrée ont des dif cul-
tés à prendre un tournant aigu sans impacter les pa-
rois des voies aériennes ; ceci explique pourquoi les
particules qui survivent au voyage à risque au travers
de l’arbre bronchique sont susceptibles de se déposer
dans les régions périphériques desservies par les voies
aériennes plus grandes et plus axiales.2 Le volume to-
tal d’air contenu au sein des branches (en moyenne)
des voies aériennes de conduction, ce qu’on appelle
« l’espace mort anatomique », est grossièrement égal
en millilitres au poids de la personnes en livres : en
d’autres mots, 154 ml pour notre prototype de jeune
homme sain de 70 kg.
La Figure 1 illustre un autre aspect d’importance
physiologique : le diamètre—et dès lors la surface
transversale—des deux branches lles dépasse celui
de la branche mère. En raison de l’augmentation ré-
gulière de la surface transversale de l’arbre trachéo-
bronchique, la résistance au débit aérien au sein du
système diminue progressivement et la vélocité de
chaque inhalation se ralentit considérablement, quand
l’air inspiré se déplace de la trachée vers l’intérieur
des poumons. En fait, dans les espaces aériens les plus
périphériques, le mouvement par « débit massif » a
cessé et l’oxygène entrant pénètre à proximité des al-
véoles par diffusion moléculaire au sein des gaz de
l’inhalation précédente.
Tant les bronches que les bronchioles sont recou-
vertes d’un épithélium (plus épais dans les premières
que dans les dernières), dont les cils battent de ma-
nière coordonnée pour propulser une couche de mu-
cus sus-jacente vers le pharynx où il est dégluti. Ce
système, connu comme le tapis roulant mucociliaire,
joue un rôle important dans l’épuration pulmonaire
des particules inhalées et des microorganismes qui se
déposent sur la couche de mucus des voies aériennes
ou sur la couche de surfactant qui recouvre les alvéoles
(description plus loin).
VAISSEAUX SANGUINS
La circulation pulmonaire commence à la sortie du
tractus pulmonaire d’écoulement depuis le ventricule
droit, comporte la valvule pulmonaire et se termine à
l’ouverture des veines pulmonaires dans l’oreillette
gauche. La fonction principale de la circulation pulmo-
naire consiste à fournir la totalité du débit cardiaque
sous forme d’un mince lm de sang vers les unités res-
piratoires terminales où ont lieu les échanges gazeux.
La circulation pulmonaire est également le site de l’in-
activation de la bradykinine et de la conversion de
l’angiotensine I en angiotensine II, ainsi que celui du
traitement des amines (par exemple, norépinéphrine et
épinéphrine) et d’autres hormones ;3 il sert aussi de ltre
du drainage veineux de l’ensemble de l’organisme.
Lors de leur évolution conjointe en arborisation
depuis le hile vers les unités respiratoires terminales,
les branches de la circulation artérielle pulmonaire se
situent côte à côte avec les branches de l’arbre bron-
chique, et sont comprises au sein du même fourreau
bronchovasculaire. A l’opposé, les veines pulmonaires,
quoiqu’également encerclées par un même fourreau
de tissu conjonctif, sont des structures solitaires qui
sont anatomiquement distantes des artères pulmo-
naires et de leurs compagnes bronchiques. Selon un
parallélisme anatomique similaire à celui du système
bronchique, les grandes artères pulmonaires centrales
circulant à côté des bronches contenant du cartilage
Figure 1 Diagramme schématique du système de bifurcation
des voies aériennes montrant qu’à chaque paire successive, une
branche est plus axiale et plus grande que l’autre et comment
cette modalité favorise la distribution des particules inhalées.
Repris à Murray2 avec la permission de l’American Thoracic
Society.

2010: Année du Poumon 3
ont des parois élastiques, alors que les petites artères
pulmonaires périphériques, partenaires des bron-
chioles membraneuses, ont des parois musculaires.
Quoiqu’elles soient appelées artères « muscu-
laires », il y a beaucoup moins de muscles lisses dans
la paroi des artères pulmonaires que dans leurs
contreparties de la circulation systémique. Ainsi, en
contraste frappant avec la circulation systémique, la
couche clairsemée du muscle dans les petites artères
pulmonaires diminue en fait encore davantage pour
disparaître nalement à l’approche du lit capillaire.4
Ces distinctions anatomiques rendent compte des
différences hémodynamiques profondes entre la cir-
culation artérielle systémique à pression élevée (pres-
sion moyenne environ 100 mm Hg), où la plus grande
partie de la chute de pression proximalement par
rapport au réseau capillaire survient au niveau d’ar-
térioles munies de muscles importants et la circula-
tion artérielle pulmonaire à basse pression (pression
moyenne 12–14 mm Hg), dans laquelle seulement
une petite fraction de la chute totale de pression se
produit au niveau des artères à paroi ne et sa plus
grande partie (70% à 80%) survient au niveau des
capillaires pulmonaires eux-mêmes.5 (Comme cela
sera discuté plus loin, la faible pression sanguine de
la circulation pulmonaire est un déterminant majeur
de la localisation de la TB pulmonaire de réinfection
[dite de type adulte]).
UNITÉS RESPIRATOIRES TERMINALES
Les sites anatomiques d’échange gazeux, c’est-à-dire
le lieu de travail terminal du poumon, sont appelés
par certains unités respiratoires terminales et par
d’autres, particulièrement les morphologistes, acini.
Les unités respiratoires terminales comportent une
série de structures associées—les bronchioles respira-
toires, les canaux alvéolaires et les alvéoles—qui pro-
viennent des bronchioles terminales.6 La transition
au départ des bronchioles terminales (dont la fonction
est de diriger le débit aérien) en unités respiratoires
terminales, dont la fonction est l’échange gazeux, ap-
parait clairement dans la micrographie scannée d’un
poumon de lapin gon é à son volume d’air habituel
(Figure 2). Toutefois, les poumons humains diffèrent
de ceux des lapins par le fait qu’il y existe une succes-
sion de bronchioles respiratoires qui se divisent et
qui ont une fonction à la fois de transit de l’air et
d’échange de gaz, mais qui deviennent progressive-
ment plus alvéolées lors des branchements successifs
(Figure 3). Finalement, les bronchioles respiratoires
se transforment en canaux alvéolaires qui sont entou-
rés par les alvéoles (Figure 4). Les gaz qui sont dans
les bronchioles respiratoires et les canaux alvéolaires
font partie du volume alvéolaire, qui constitue la to-
talité des 4,3 l d’air trouvé dans les poumons de notre
sujet modèle humain, à l’exception des 155 ml de
l’espace mort anatomique.
Le secret anatomique de l’échange optimal de
gaz dépend du fait d’avoir une membrane vaste—
mais extrêmement ne—qui se situe entre les gaz d’un
côté, et le sang de l’autre côté, exactement comme
c’est la cas dans les poumons humains (Tableau).1 La
zone de surface alvéolaire totale qui fait face aux
Figure 2 Micrographie électronique scannée d’un poumon
de lapin gonfl é au volume respiratoire normal et montrant les
bifurcations dichotomiques d’une bronchiole terminale condui-
sant à des bronchioles respiratoires partiellement alvéolées jus-
qu’aux canaux alvéolaires et aux alvéoles. Repris à Weibel1 avec
permission.
Figure 3 Représentation schématique des subdivisions anato-
miques dans un seul plan au travers d’une unité respiratoire ter-
minale humaine (c’est-à-dire les structures distales par rapport
à une bronchiole terminale, TB). Les nombres romains indiquent
les bronchioles respiratoires et les nombres arabes les conduits
alvéolaires. L’entièreté de l’unité peut être visualisée en faisant
tourner les structures jusqu’à 360 degrés au sein de la zone ha-
churée. Repris à Murray6 avec la permission de l’éditeur.

4 The International Journal of Tuberculosis and Lung Disease
molécules d’oxygène de l’air inhalé frais est en effet
énorme (130 m2), presque exactement la moitié de la
taille d’un court de tennis pour doubles (261 m2). De
plus, la plus grande partie de la surface alvéolaire est
conjointe à la surface voisine des capillaires pulmo-
naires (115 m2), dans laquelle le sang veineux mêlé,
incomplètement oxygéné, circule de manière constante.
Lorsque l’organisme est au repos, les capillaires pul-
monaires contiennent environ 200 ml de sang. Mais
le volume des globules rouges et de leur élément vital,
l’hémoglobine porteuse d’oxygène, peuvent augmen-
ter considérablement par le recrutement de capillaires
préalablement non remplis et par la dilatation d’autres
dans lesquels le sang était déjà en circulation—un
engorgement qui contribue de manière importante à
l’augmentation de la résorption d’oxygène qui est
multipliée par dix au cours d’un exercice violent.
Les capillaires pulmonaires, de petits tuyaux à pa-
roi ne formés des prolongements cytoplasmiques
aplatis des cellules endothéliales, occupent presque la
totalité des parois alvéolaires (88% ; Figure 5), mais
ont deux pro ls anatomiques différents qui dépen-
dent de la position des prolongements des cellules
épithéliales alvéolaires de type I, prolongements à pa-
rois nes qui les recouvrent et qui ont été comparées
à des œufs sur le plat : les prolongements cytoplas-
miques à taille des cellules représentant le blanc d’œuf
plat alors que le noyau central représente le jaune
d’œuf. Sur plus de la moitié de la circonférence des
capillaires, les cellules endothéliales capillaires et les
cellules épithéliales alvéolaires adhèrent étroitement
les unes aux autres par leurs membranes basales fu-
sionnées en une seule couche, formant par là la por-
tion ne de la barrière alvéolo-capillaire (barrière air-
sang ; Figure 6). A l’opposé, dans le périmètre capillaire
Figure 4 Micrographie électronique scannée du parenchyme
pulmonaire humain, montrant le conduit alvéolaire surmonté
par les alvéoles, qui sont séparées par de fi ns septums. Repris à
Weibel1 avec permission.
Tableau Estimations—dérivées de l’analyse
morphométrique—des observations typiques dans les
poumons d’un homme adulte sain, mesurant 1,75 m et pesant
70 kg, gonfl és à 60% de la capacité pulmonaire totale, soit
environ au volume existant à la fi n d’une inspiration usuelle*
Variable Moyenne DS
Volume pulmonaire, ml 4.340 285
Zone de surface alvéolaire, m2 130 12
Zone de surface capillaire, m2 115 12
Volume sanguin capillaire, ml 194 30
*
Données de Weibel.1
DS = déviation standard.
Figure 5 Micrographie électronique scannée d’un poumon
humain montrant une partie de la paroi alvéolaire étroitement
associée aux capillaires pulmonaires contenant des globules
rouges qui sont séparés de l’air par une barrière tissulaire très
fi ne (voir Figure 6). Repris à Weibel1 avec permission.
Figure 6 Micrographie électronique d’un seul capillaire pul-
monaire contenant des globules rouges (RBC), suspendu dans
un septum alvéolaire avec un espace alvéolaire (AS) de chaque
côté. La portion « fi ne » de la barrière air-sang se trouve du
côté gauche où l’extension des cellules épithéliales alvéolaires
de type I (EP) et les extensions sous-jacentes de la cellule endo-
théliale capillaire (EN) reposent sur une membrane basale fu-
sionnée (BM). La portion « épaisse » se situe du côté droit où
les deux couches cellulaires sont séparées par un espace inter-
stitiel (IS). Barre horizontale = 1 μm. Modifi é à partir de Murray6
et reproduit avec la permission de l’éditeur.

2010: Année du Poumon 5
restant, les couches de cellules endothéliales et épithé-
liales sont séparées l’une de l’autre par un espace in-
terstitiel contenant un petit nombre de bres conjonc-
tives de soutien, qui forment la partie épaisse de la
barrière. Les capillaires alvéolaires trouvent leur che-
min au travers du septum alvéolaire de telle manière
que leurs portions minces coulissent d’un côté à l’autre,
faisant face alternativement à un espace alvéolaire
et à son voisin—de façon à faciliter les échanges ga-
zeux (voyez plus bas)—alors que les portions épaisses
restent alignées dans la direction des septa.
La résorption d’oxygène et la libération du dioxyde
carbone surviennent chacune par diffusion passive
des molécules par suite des différences des pressions
partielles des deux gaz de part et d’autre de la mem-
brane alvéolo-capillaire. Mais la diffusion est égale-
ment in uencée de manière importante par l’épais-
seur de la membrane, et pour l’oxygène par la distance
entre la source des molécules dans l’espace alvéolaire
et leur liaison chimique nale avec l’hémoglobine à
l’intérieur des globules rouges : la diffusion est d’autant
plus grande que la distance est plus faible. De la même
manière, les échanges gazeux surviennent de manière
préférentielle à travers la portion ne de la bar rière
alvéolo-capillaire alors que les échanges des liquides
et de solubles entre la lumière capillaire et l’espace
interstitiel se produisent dans la portion épaisse. (Nous
n’avons pas assez de place pour discuter ici du fait
que les anomalies des échanges des liquides et des so-
lubles sont à la base de la formation d’œdème pulmo-
naire, le sujet peut-être d’un autre article).
Une caractéristique plus structurelle des unités res-
piratoires terminales mérite une attention particulière :
la totalité de la surface alvéolaire est couverte d’une
couche de l’épaisseur d’une molécule par un matériel
chimique remarquable appelé le surfactant, qui est
synthétisé et libéré par les cellules épithéliales alvéo-
laires de type II. Le surfactant stabilise les alvéoles par
sa capacité extraordinaire à réduire la tension super-
cielle lors de la diminution du volume pulmonaire
au cours de l’expiration. Bien que 90% de la surface
alvéolaire soient couverts par les cellules de type I
ressemblant à un œuf sur le plat, l’épithélium contient
en fait un plus grand nombre de cellules alvéolaires
de type II, productrices de surfactant et de taille plus
réduite, ce qui fait ressortir leur importance fonction-
nelle, particulièrement dans les poumons des nouveau-
nés dont les alvéoles sont nes et susceptibles de se
collaber. Le surfactant stabilise également les poumons
d’adultes, ce qui garantit les échanges gazeux.
INNERVATION
Les poumons se défendent eux-mêmes—et du coup le
reste du corps—par des ré exes de protection, parmi
lesquels le ré exe de toux est le plus évident et cer-
taine ment le mieux étudié. Mais plus on investigue
la toux, plus compliquée elle paraît. La toux chez
l’homme semble déclenchée par la stimulation méca-
nique ou chimique de récepteurs d’irritation à adap-
tation rapide situés dans l’épithélium des voies aé ri-
ennes du larynx aux bronchioles, principalement aux
points d’embranchement, mais dont l’abondance dé-
croit au fur et à mesure de la progression vers la péri-
phérie des voies aériennes. Les mêmes stimuli activent
d’autres récepteurs sensoriels, les fibres pulmonaires
et bronchiques C, et dans une moindre mesure les ré-
cepteurs à adaptation lente dont l’arrivée dans le
système nerveux central, tous via le nerf vague, peut
supprimer ou ampli er la réponse de toux qui en
résulte.7
L’acte de la toux exige une contraction vigoureuse
des muscles thoraciques et abdominaux qui, comme
d’autres muscles striés, sont innervés par les neurones
moteurs, mais qui reçoivent des ordres provenant d’un
« centre du système nerveux central de la toux ». Les
muscles qui contribuent à la respiration, connus dans
leur ensemble comme muscles respiratoires, parmi
lesquels le diaphragme est de loin le plus important et
le mieux étudié, sont particulièrement bien dotés sur
le plan physiologique. Selon McKenzie et coll.,8 les
muscles respiratoires sont substantiellement différents
de leurs équivalents non respiratoires : ils doivent tra-
vailler pour la durée de vie de leurs propriétaires sans
un repos prolongé ; ils sont plus résistants au déve-
loppement de la fatigue et en récupèrent plus rapide-
ment ; ils ont un débit sanguin et une densité capillaire
plus importants ; et leur consommation maximale
d’oxygène est de deux à six fois supérieure.
L’innervation efférente des poumons proprement
dits comporte les bres parasympathiques (choliner-
giques) et sympathiques (adrénergiques) qui condui-
sent aux voies aériennes et aux muscles lisses des
vaisseaux, aux glandes sécrétrices de mucus et à la
muqueuse. L’activité cholinergique est prédominante
dans toutes les espèces de mammifères étudiées, y
compris les hommes, et elle entraîne la broncho-
constriction et la sécrétion de mucus dans les voies
aériennes. Bien que les récepteurs adrénergiques soient
nombreux et répondent à des stimulations chimiques
et au blocage (comme dans le traitement de l’asthme),
les réponses à la stimulation des nerfs sympathiques
sont étonnamment faibles. Des bres peptidergiques
ont également été identi ées, mais leur rôle physiolo-
gique n’a pas encore été dé ni complètement. De la
même manière, la fonction des corps neuroépithé-
liaux des voies aériennes n’est guère connue ; certains
faits suggèrent qu’ils pourraient jouer le rôle de chimio-
récepteurs chez le fœtus et le nouveau-né.
AUTRES STRUCTURES
Vu la place limitée disponible, nous ne pouvons pas
aborder diverses autres structures qui contribuent
de manière importante au bien-être du poumon,
tels les lymphatiques pulmonaires,9 la circulation
 6
6
 7
7
1
/
7
100%