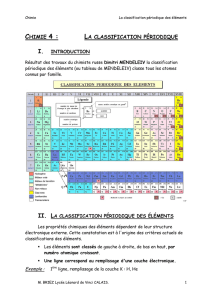
Classification périodique des éléments Familles chimiques I

Chimie
P2/CH3/TP n°10
Partie Chapitre
Constitution de la matière La classification périodique des éléments
1
Classification périodique des éléments
Familles chimiques
Objectifs :
• Présentation de la classification périodique des éléments.
• Montrer que les éléments d'une même famille chimique ont des propriétés similaires.
I.
Présentation de la classification périodique des éléments.
1) Combien de lignes (appelées périodes) et colonnes (appelées familles d’éléments) composent la classification périodique
des éléments ?
2) Relever les symboles et numéros atomiques des 18 premiers éléments de la classification périodiques des éléments puis
compléter le tableau ci-dessous, représentant les 3 premières périodes de la classification :
Colonne 1 Colonne 2 Colonne 13 Colonne 14 Colonne 15 Colonne 16 Colonne 17 Colonne 18
Période 1 H, Z = 1
(K)
1
Période 2
Période 3 Ar, Z = 18
(K)
2
(L)
8
(M)
8
3) Comment sont classés les éléments chimiques en fonction du numéro atomique Z ?
4) Combien d’éléments contient la première période ? A quelle couche électronique correspond-elle ?
5) Mêmes questions pour la deuxième période.
6) Que peut-on dire de la structure électronique des éléments chimiques lorsqu’on passe d’une période à une autre ?
7) Combien d’électron(s) externes possède(nt) les éléments des colonnes 1 et 2 ?
8) Mêmes questions pour les éléments des colonnes 16, 17 et 18.
9) Que peut-on dire, de façon générale, de la structure électronique des éléments d’une même famille ?

Chimie
P2/CH3/TP n°10
Partie Chapitre
Constitution de la matière La classification périodique des éléments
2
II.
Familles chimiques
Définition d’une famille chimique : Une famille chimique est constituée par les éléments chimiques appartenant à une même
colonne de la classification périodique des éléments.
La 1
ere
colonne correspond à la famille des alcalins.
La 17
eme
colonne correspond à la famille des halogènes.
La 18
eme
colonne correspond à la famille des gaz nobles.
Ex : Le fluor, le chlore le brome et l’iode appartiennent à la famille des halogènes.
1.
Molécules et ions monoatomiques
10) Que peut-on dire du nombre d’électrons périphériques des éléments appartenant à une même famille chimique ?
11) Que peut-on en déduire sur la charge électrique des éléments appartenant à une même famille chimique ?
12) Que peut-on en déduire sur le nombre de liaisons que peuvent établir des éléments appartenant à une même famille
chimique ?
Ce résultat se généralise pour les éléments chimiques tels que Z > 18 pour les colonnes 1,2, 16 et 17 de la classification.
13) En utilisant la classification périodique, retrouver la charge des ions monoatomiques et le nombre de liaisons que peuvent
établir les éléments de chacune des familles de la colonne du carbone, de l’azote, de l’oxygène et du fluor.
2.
La famille des halogènes
Le chlore, le brome et l’iode appartiennent à la famille des halogènes.
Expérience :
Mettre environ 1mL de chlorure de potassium (K
+
+ Cl
-
) dans deux tubes à essais 1 et 2, 1mL de Bromure de potassium (K
+
+
Br
-
) dans deux autres tube à essais 3 et 4 et 1 mL de iodure de potassium (K
+
+ I
-
) dans deux autres tubes à essais 5 et 6.
Mettre quelques gouttes de nitrate d’argent (Ag
+
+ NO
3
-
) dans les tubes 1, 3 et 5 et quelques gouttes de nitrate de plomb
(Pb
2+
+ 2NO
3
-
) dans les tubes 2, 4 et 6.
14) Noter les observations pour chacun des tubes à essais
15) Que peut-on dire du comportement des halogènes avec les ions Ag
+
et Pb2
+
.
16) Conclusion : que peut-on dire des propriétés chimiques des halogènes et plus généralement des éléments appartenant à
une même famille chimique ?
III.
Exercices
1.
Familles chimiques
Dans la classification périodique donnée dans ce TP, localiser (en les surlignant) les familles des alcalins, des halogènes et des gaz
nobles (ou « rares »).
2.
Ex 17 p 102
La structure électronique d’un atome est (K)
2
(L)
6
.
a. Quelle est la place de l’élément chimique correspondant dans la classification périodique ? Donner son symbole
chimique et son nom.
b. Quel est le numéro atomique de cet élément chimique ?
c. Combien l’atome possède-t-il d’électrons ? Quel ion monoatomique cet atome est-il susceptible de donner ? Justifier
la réponse.
3.
Ex 24 p 102
Un atome X engage deux liaisons covalentes lorsqu’il forme des molécules.
a. Combien d’électrons périphériques possède-t-il ?
b. Dans quelle colonne du tableau périodique se trouve l’élément chimique correspondant ?
c. Sachant que sa couche électronique externe est la couche M, trouver quel est cet atome.
d. Donner un exemple de molécule qui comporte un ou plusieurs de ces atomes. Donner également la représentation
de Lewis de cette molécule.
1
/
2
100%