Sujet - Eric Mondot.

Professeur : Mmes Lefevre, Lefort, Majorel Mrs Amrane, Barrandon , Mondot Le 03/05/2016
Durée : 3H30.
1/11
DEVOIR SURVEILLE DE SCIENCES PHYSIQUES
TLE S
L’UTILISATION DES CALCULATRICES EST AUTORISÉE
LE CANDIDAT DOIT TRAITER TROIS EXERCICES, QUI SONT INDÉPENDANTS
LES UNS DES AUTRES
ATTENTION : C’EST LA DERNIÈRE ÉVALUATION DE L’ANNÉE ; LA
PROCHAINE, C’EST LE BAC !!!
LA SOLUTION DES EXERCICES SERA RÉDIGÉE EN FAISANT ATTENTION
À L’ORTHOGRAPHE ET À L’EXPRESSION ÉCRITE.
EXERCICE 1 : A LA FOIRE… (7 points)
Compétences :
Définir, reconnaître et caractériser des mouvements dans un référentiel d’étude
Connaître et exploiter le principe d’inertie
Etablir et exploiter l’expression du travail de la force de pesanteur ou d’une force de frottement
Analyser des transferts énergétiques au cours des mouvements
Faire l’étude énergétique d’un oscillateur
Mettre en évidence l’amortissement et la dissipation d’énergie
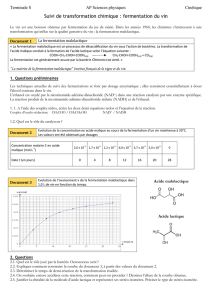
Document 1 : Looping dans un parc d'attraction.
En 2015, un parc d'attraction s'est doté d'un nouveau grand huit à fortes sensations. On peut lire sur le
descriptif :
« Top départ, c'est parti.... de 0 à 100 km/h en 2,5 secondes chrono !
Ce démarrage se fait à partir du point A (voir schéma document 2). Après la descente AB, le visiteur
enchaîne un looping d’une hauteur de 40 m (point D), un instant de pure adrénaline ! Sensation nouvelle
pour le visiteur ...qui se retrouve avec la tête à l'envers. »
Données : 1 tonne vaut 1000 kg – M préfixe Mega correspondant à 106 .
Document 2 : Photo du looping et schéma du looping modélisé
1. Calculer la valeur numérique de l'accélération du wagon pendant la phase de la descente AB. Comparer
à g = 9,8 m s-2.
x
D
BD = 40 m

Professeur : Mmes Lefevre, Lefort, Majorel Mrs Amrane, Barrandon , Mondot Le 03/05/2016
Durée : 3H30.
2/11
Le looping simplifié est constitué d'une gouttière de lancement dont le point le plus haut A est situé à
une hauteur h au-dessus du sol et permet de guider un chariot vers un rail circulaire de rayon R. Le point
culminant du looping est le point D.
Le chariot et ses occupants ont une masse m = 10 tonnes. Pour simplifier l’étude mécanique, le
système S {chariot – occupants} est assimilé à un point matériel C.
L'étude du mouvement est réalisée dans le référentiel terrestre R0 supposé galiléen.
Dans un premier temps, le modèle adopté suppose l’absence de toutes formes de frottements (les
frottements de l'air sur le chariot et les passagers et de la gouttière sur le chariot sont négligés). Le chariot
est immobile en A.
Aucun calcul numérique n’est attendu concernant les questions 2 à 11 !
2. Quelles formes d’énergies le système S possède-t-il sur le trajet AD ?
3. Donner l’expression du travail du poids du système S sur le trajet AB en précisant les unités des
différentes grandeurs. Pourquoi dit-on que le poids est une force conservative ?
4. Pour chacune des phases AB et BD du mouvement, préciser si le travail du poids du système S est
moteur ou résistant en justifiant la réponse.
5. Comment évolue chacune des formes d’énergies au cours des différentes phases du mouvement lors
des trajets AB et BD ?
6. En quel point de la trajectoire la vitesse de S est-elle maximale ? Justifier.
7. Exprimer l’énergie mécanique du système au point A. On prendra l’origine des énergies potentielles au
point B tel que z = 0.
8. L’énergie mécanique du système au point B a-t-elle même valeur qu’au point A ? Justifier.
9. En déduire l’expression de la vitesse lorsque le système arrive en B en fonction de h et g.
10. Dans le cas où il y a des frottements, comment évolue l’énergie mécanique ?
Désormais l’hypothèse d'absence de frottement de l'air est abandonnée. Une simulation numérique permet
d'obtenir les courbes suivantes : évolution au cours du temps de l'énergie cinétique Ec, de l'énergie
potentielle Ep, de l'énergie totale EM. L'origine de l'énergie potentielle est prise au point le plus bas du
looping. A l'instant t=0, on abandonne le chariot au point A sans vitesse initiale.
11. Associer à chaque courbe la grandeur associée en justifiant chaque réponse.
Document 3 : Courbes obtenues par simulation numérique
12. En vous appuyant sur le document 3, quel est le trajet effectué par le système au bout de 30 s ? Que
peut-on dire de l’énergie mécanique pendant ce temps ?
13. Evaluer le travail des forces de frottements. Pourquoi dans ce cas les forces de frottements sont non
conservatives ? Sous quelle forme cette énergie perdue est-elle dissipée ?

Professeur : Mmes Lefevre, Lefort, Majorel Mrs Amrane, Barrandon , Mondot Le 03/05/2016
Durée : 3H30.
3/11
EXERCICE 2 : Elaboration du vin de Champagne, les fermentations …(8 points)
Compétences :
Utiliser la représentation topologique
Suivre l’évolution dans le temps d’une réaction chimique
Connaître quelques paramètres influençant l’évolution temporelle d’une réaction chimique
Repérer l’équivalence d’un titrage conductimétrique
Le vin de Champagne est élaboré selon la méthode champenoise, parfois appelée méthode
traditionnelle, qui consiste principalement à opérer une double fermentation du moût, la première en cuves,
la seconde dans la bouteille même, en cave. La croyance populaire veut que cette méthode soit l'invention
de dom Pérignon, moine de l'abbaye d'Hautvillers, près d'Épernay, dans le dernier quart du XVIIe siècle.
Aujourd'hui, les historiens s'accordent plutôt pour dire qu'il est seulement à l'origine de la technique de
l'assemblage.
Une fermentation malo-lactique peut également être réalisée.
Cave de Champagne : à Reims, les anciennes crayères sont
réutilisées comme cave pour l’élaboration et le stockage du vin
de Champagne
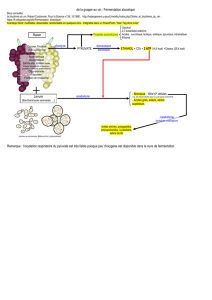
Document 1 : La fermentation par des levures
La première fermentation ou fermentation
alcoolique permet la transformation du sucre
contenu dans le jus de raisin (principalement le
glucose C6H12O6) en éthanol C2H6O et en dioxyde
de carbone CO2 exclusivement, elle s’accompagne
d'une élévation de température.
Cette réaction a lieu au sein de levures (les
levures sont des champignons microscopiques) qui
contiennent des enzymes capables de catalyser la
transformation. Le dioxyde de carbone formé
s’échappe sous forme de gaz. A l’issue de cette
transformation, on obtient le vin dit « de base ».
Modèle moléculaire éclaté du glucose
Les levures produisent également :
Des composés secondaires : de l’acide malique, des alcools supérieurs, du glycérols
(glycérine), de l’acide succinique, de l’acide acétique (c'est le composant principal de l'acidité volatile) et
des substances aromatiques .
Les arômes issus du raisin ou arômes variétaux sont dits primaires ; ils sont dits secondaires
lorsqu'issus de la fermentation ; ceux qui se développent au cours de l'élevage du vin ou de
l'évolution en bouteille, sont dits tertiaires.

Professeur : Mmes Lefevre, Lefort, Majorel Mrs Amrane, Barrandon , Mondot Le 03/05/2016
Durée : 3H30.
4/11
Document 2 : La fermentation malolactique ou FML dans les vins
Sur le site de l’IFV, Institut Français de la Vigne et du Vin, on trouve la présentation d’une
fermentation particulière au cours de l’élaboration d’un vin : la fermentation malolactique. Voici un extrait
de cette présentation :
« La fermentation malolactique, ou FML, influence la qualité organoleptique des vins,
particulièrement celle des vins rouges. Les modifications qualitatives dépassent largement la simple
modification de l’acidité. »
Qu'est-ce que la fermentation malolactique ?
La fermentation malo-lactique permet de réduire l’acidité d’un vin. Elle met en jeu la transformation
de l’acide malique en acide lactique par le biais de bactéries, du dioxyde de carbone étant par ailleurs
libéré par cette réaction. Certaines maisons de champagne décident de réaliser
cette transformation, d’autres préfèrent ne pas la mettre en œuvre : c’est une
affaire de goût.
La transformation de l'acide malique se réalise selon l'équation suivante :
COOH-CHOH-CH2-COOH
CH3-CHOH-COOH + CO2
La fermentation malolactique ou FML est généralement assurée par une
espèce de bactérie lactique : Oenococcusoeni, anciennement appelée Leuconostocoenos.
Pourquoi réaliser la fermentation malolactique ?
La fermentation malolactique s'impose pour l'ensemble des vins rouges puisqu'elle confère
souplesse, rondeur et stabilité microbiologique. Concernant les vins blancs, la fermentation malolactique
est recherchée en zone septentrionale et est plus rare en zone plus chaudes. Alors que certains cépages
comme le Chardonnay sont mis en valeur, d'autres comme le Sauvignon Blanc riches en arômes variétaux
sont complètement transformés.
Document 3 : Quelques acides présents dans le champagne
Document 4 : La chromatographie et la liaison hydrogène
On peut suivre la fermentation grâce à une chromatographie sur papier Whatman, constitué de
cellulose. L'éluant est un mélange butanol / acide éthanoïque. La cellulose contient des groupes -OH et
des ponts C-O-C capables de mettre en jeu des interactions hydrogène. Plus un composé va pouvoir
établir des interactions hydrogène avec la cellulose, moins il va migrer.
La liaison hydrogène ou pont hydrogène est une force intermoléculaire impliquant un atome
d'hydrogène et un atome électronégatif comme l'oxygène.

Professeur : Mmes Lefevre, Lefort, Majorel Mrs Amrane, Barrandon , Mondot Le 03/05/2016
Durée : 3H30.
5/11
Structure de la cellulose
Liaison hydrogène entre des molécules d'eau
Document 5 : Suivi de la fermentation malolactique ou FML dans les vins par chromatographie
La chromatographie de partage sur papier permet de différencier les acides organiques du vin :
l'acide malique, tartrique et lactique. Cette technique, même si elle ne remplace pas le dosage
enzymatique de l'acide malique permet de savoir si la Fermentation Malolactique est commencée, en
cours ou presque achevée.
Chromatogramme de 4 échantillons de champagne subissant une fermentation malo-lactique
Remarque : le fond du chromatogramme est bleu et les taches sont jaunâtres.
Document 6 : Dosage de l’acide malique de l’échantillon 2 du document 5
Un dosage enzymatique de l’acide malique restant dans le vin permet d’obtenir la concentration
massique en acide malique Cmalique(t) en fonction du temps.
Cela permet de déduire la quantité de matière x(t) produite en acide lactique en fonction du
temps :
t en jours
0
4
8
12
16
20
28
Cmalique(t) en g.L-1
3,5
2,3
1,6
0,80
0,50
0,27
0
x(t) en mol
0
0,0090
0,014
0,020
0,022
0,024
0,026
D’après ces mesures on obtient le graphe représentant x en fonction du temps suivant :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%