TP n°8 Chimie - Accueil

TP CHIMIE – 2° Page 1 http://physiquark.free.fr
TP n°8 : Règle du duet et de l’octet
But : * Mettre en évidence l’inertie chimique des gaz nobles
* Mettre en évidence la grande réactivité de l’atome de sodium.
* Enoncer la règle du duet et de l’octet.
I) Les gaz nobles (ou gaz rares)
1) Citer les noms des différents gaz nobles.
Quels sont les symboles de ces éléments?
Nom Symbole
2) Les gaz nobles sont-ils constitués de molécules ? Pourquoi ?
Quelle propriété chimique caractérise donc les gaz nobles?
3) Quel est le gaz utilisé pour gonfler les aérostats, les ballons météos et les
dirigeables ?
Pourquoi ce gaz a-t-il remplacé le dihydrogène dans les dirigeables ?
Quel est l’autre utilisation de ce gaz noble ?
4) Quels sont les gaz utilisés dans les tubes à décharge ( enseignes lumineuses ) ?
Pourquoi utilise-t-on ces gaz ?
5) Quelle est la structure électronique des 4 premiers gaz rares ?
Nom
Symbole
Z
nombre d’électrons
Structure électronique
Les gaz nobles, dont l'Hélium fait partie, sont des
éléments chimiques très stables. Le texte qui suit
présente cette famille d'éléments de façon humoristique,
sous la forme d'une lettre de « l'Association des
éléments chimiques » adressée à « Monsieur Hélium et
à sa famille »
DOCUMENT
Cher monsieur Hélium,
Nous vous invitons à venir participer, avec votre famille,
à l'assemblée générale des éléments chimiques. Vous
viendrez accompagné de vos frères Néon, Argon,
Krypton et Xénon. Comme vous êtes tous mauvais
conducteurs, une limousine viendra vous chercher.
A l'issue de la réunion, vous vous verrez remettre le
grand Prix de la Stabilité. En effet, les états de service
de votre famille constituent un cas unique parmi les
éléments chimiques : vous êtes les seuls éléments à
rester sous forme atomique et, sauf à de très rares
exceptions, vous n'acceptez pas les liaisons ! Quel soit
votre entourage, vous n'intervenez jamais dans les
réactions chimiques. On vous dit inertes et on vous
envie votre stabilité. De nombreux éléments tentent
même de vous imiter en adoptant ou en abandonnant
des électrons.
Si vous êtes chimiquement inertes, vous intervenez par
contre dans de nombreux domaines de la physique.
Vous, monsieur Hélium, êtes très léger, comme
Hydrogène, mais, contrairement à lui, vous n'êtes pas
explosif ; on vous utilise pour gonfler les ballons
dirigeables. Vous avez pris la place de monsieur Azote
dans les bouteilles de plongée sous-marine pour former
avec Oxygène, un mélange plus sûr pour la respiration
des plongeurs.
On vous a longtemps qualifié de rare, mais aujourd'hui,
on sait que vous, Hélium, êtes, après Hydrogène,
l'élément chimique le plus courant dans l'Univers. Vous
êtes, en particulier, très abondant dans le Soleil. Vos
frères sont très présents dans notre quotidien. On les
trouve dans les tubes « néon ». Argon, Krypton et Xénon
protègent le filament des lampes à incandescence.
Néon et Argon jouent un rôle important dans la lumière
laser, source de nombreuses applications industrielles et
médicales.
Nous serons donc très honorés de vous accueillir et de
vous remettre votre prix. Dans cette attente, veuillez
agréer l'expression de nos meilleurs sentiments.
L'association des éléments chimiques.

TP CHIMIE – 2° Page 2 http://physiquark.free.fr
II) Structure électronique de quelques ions:
Un atome ne peut capter ou céder des électrons de façon aléatoire pour se transformer en ion.
Pour comprendre quelles règles régissent la formation des ions, étudions la structure électronique de certains d’entre eux.
1) Compléter le tableau:
Symbole de l’atome
Z
Structure électronique
de l’atome
Symbole de l’ion
correspondant Li+Be2+ Mg2+ F-O2- Cl-
Nombre d’électrons
Structure électronique
de l’ion
Contrairement aux gaz rares, on ne rencontre jamais, dans la nature, ces éléments sous forme d’atome isolés ; par contre on
peut rencontrer leurs ions.
2) Comment expliquer cette observation à partir des structures électroniques ?
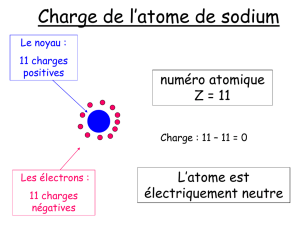
III) L’élément sodium:
* L’élément sodium peut se trouver sous forme atomique, dans le métal de formule Na.
* L’élément sodium peut de trouver sous forme ionique, Na+, dans les composés ioniques solides ou en solution.
Essayons de montrer expérimentalement quelle est sa forme la plus stable.
1) L’ion sodium Na +
:
11) Rencontre-t-on les ions sodium Na +
dans la nature ?
12) Comment les mettre en évidence ?
2) Le métal sodium Na:
21) Comment conserve-t-on ce métal ? Pourquoi ?
22) Réaction avec l’eau:
221) Exp :
222) Interprétation :
23) Comparer les structures électroniques des 2 entités chimiques de l’élément sodium
Entité chimique Symbole Z Nombre d’électrons Structure électronique
atome de sodium
ion sodium
24) Quelle est l’entité la plus stable ? Le métal sodium peut-il exister dans la nature ?
Na
Eau Eau
puis puis
.............................. .............................. ..............................
1
/
2
100%