Revue CNSF 2011_ 1ère Partie - B3 _Adapt Métaboliques-1

PREMIERE PARTIE : LES BASES de NOTRE EXERCICE
B- Physiologie de l’adaptation du nouveau-né à la vie extra utérine
B-3- Adaptations métaboliques
Nous retiendrons 3 métabolismes : glucose, calcium et bilirubine, qui par leur importance et
leurs possible décompensations justifient toute notre vigilance.
1- Le métabolisme du glucose
1-1 In utéro
En situation normale, le fœtus ne produit pas de glucose, sa glycémie est assurée et
maintenue de manière passive et continue grâce au glucose maternel. Il existe une relation
linéaire entre la glycémie maternelle et celle du fœtus, en permanence égale à 70-80% de
la glycémie maternelle.
En réponse, dès la 20ème SA, le pancréas fœtal secrète de l’insuline qui permet l’entrée du
glucose dans les cellules pour utilisation ou stockage, et diminue la glycémie. Le nombre de
récepteurs à l’insuline est très élevé. C’est à partir du 3ème trimestre de grossesse que
l’insuline favorise le stockage des réserves énergétiques : glycogène dans le foie (à terme
50 mg par gramme de tissu hépatique), lipides sous forme de triglycérides dans le tissu
adipeux (16 à 18% du corps) et acides aminés amenés dans le tissu musculaire tandis que
la synthèse des protéines musculaires est activée.
1-2 Après la naissance
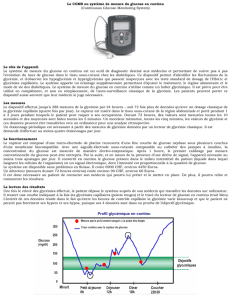
L’interruption brutale du flux de glucose par le clampage du cordon, provoque dans les 2
premières heures, une hypoglycémie transitoire (maximum à 1h de vie), asymptomatique,
tout à fait physiologique, liée aux dépenses immédiates et au délai nécessaire pour la
mobilisation du glucose. Les mécanismes contribuant à maintenir la glycémie sont alors
sollicités, et sont induits par la diminution de la sécrétion d’insuline et l’augmentation
majeure des hormones de stress : catécholamines (x 3 à 10), glucagon (x 3 à 5 et
augmentation importante du nombre de récepteurs), corticoïdes, TSH, et hormone de
croissance. Ils agissent par :
- glycogénolyse sous l’action du le glucagon, à partir du glycogène. Cette réaction assure
la glycémie pendant les 12 premières heures, au-delà le stock de glycogène est épuisé.
- néoglucogenèse à partir de précurseurs non glucidiques : lactate, pyruvate, glycérol,
alanine et autres acides aminés fournis par protéolyse, dits glucoformateurs, et activée par
des cofacteurs issus de l’oxydation des acides gras. Elle débute 2-3h après la naissance et
est maximale vers la 12ème heure.
- lipolyse qui libère du glycérol dont la plus grande partie entre directement dans la chaîne
de la néoglucogenèse, et des acides gras libres, substrats énergétiques directement
utilisables par les muscles, le cœur et les reins. Une partie de ces acides gras est oxydée
en corps cétoniques, énergie alternative pour le cerveau.
- 1 -

Si ces mécanismes sont défaillants, des énergies alternatives sont utilisées par le
cerveau :
- les corps cétoniques, dont la concentration cérébrale, faible pendant les 8 premières
heures, est maximale à partir de la 12ème heure et se maintient pendant les 2-3 jours
suivants. Ils sont transportés dans le cerveau en fonction de leur concentration sanguine,
plus élevée en cas de régime riche en graisses.
- l’acide lactique dont la concentration sérique est élevée pendant les 3 premières heures
de vie, représente jusqu’à 60% du métabolisme cérébral.
La glycémie remonte ensuite spontanément si on évite au nouveau- né des dépenses
énergétiques inutiles donc si l’environnement est thermoneutre, s’il bénéficie d’une
alimentation dès qu’il en exprime l’envie (mouvements de succion, de recherche) et si le
stress est évité ou limité.
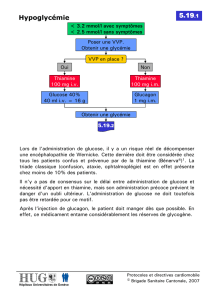
Dans ces conditions et quand l’adaptation est correcte, la glycémie se maintient à un taux
supérieur à 0,40 g/l : Glycémie normale du nouveau- né à terme= 0,45 g/l = 2,4 mmol/l
et le dextrostix systématique avant 2h de vie n’est pas justifié, ni au-delà en l’absence de
facteurs de risques et sous réserve d’un environnement optimal.
A l’inverse, l’hypothermie, la déshydratation, une 1ère tétée trop tardive ou des tétées trop
espacées, et un stress excessif peuvent être responsable d’hypoglycémie.
L’hypoglycémie est pathologique si la glycémie est < 0,3 g/l entre 0 et 3 h de vie
et < 0,4 g/l entre 3h et 48h.
En cas de refroidissement, la graisse brune est mobilisée .Cette graisse spécifique se
reconstituant au moment des repas, nécessite alors une certaine quantité de glucose.
Si les apports alimentaires sont limités, cette reconstitution se fait au détriment de la
recharge du foie en glycogène, et entretient le mécanisme d’hypoglycémie. La perfusion
systématique de sérum glucosé à la mère, habituelle pendant le travail y contribuerait.
1-3 Pendant les premiers jours de vie
L’équilibre de la glycémie et son maintien à la norme de 0,45g/l est fonction de la production
endogène de glucose, des apports alimentaires, et de la limitation des dépenses.
A J 3-J 4, on peut observer une hypoglycémie transitoire, avec manifestations cliniques à
type de trémulations, agitation, elle est à distinguer d’une hypocalcémie et se corrige avant
tout par l’alimentation.
2 – Le métabolisme du calcium
Le maintien d’une calcémie normale à 100 mg/l soit 2mmol/l est conditionné par l’équilibre
entre la calcitonine thyroïdienne qui assure le dépôt de Ca sur les os, et la parathormone
parathyroïdienne qui en assure le relarguage dans le sang.
L’hypocalcémie fréquente des premiers jours, est liée à un défaut d’adaptation de la
sécrétion de parathormone. Elle se traduit cliniquement par une agitation, une irritabilité, des
trémulations voire des convulsions sans gravité dans ce cas. Le diagnostic différentiel peut
être fait très facilement avec l’hypoglycémie. Le traitement associe une alimentation
efficace, l’apport de Ca (gluconate de Ca) et Vitamine D, autorisés aux sages-femmes.
- 2 -

3- Le métabolisme de la bilirubine
A partir de la naissance, une hyperbilirubinémie s’installe progressivement résultant de
l’hémolyse physiologique des globules rouges : le nouveau-né produit 2 fois plus de
bilirubine que l’adulte en raison d’une demi-vie plus courte de ses globules rouges, d’une
masse globulaire proportionnellement plus élevée, et d’une libération importante d’hème
non globulaire lors de l’accouchement.
La plus grande partie de la bilirubine est liée à l’albumine. Elle subit dans le foie une
conjugaison avec l’acide glycuronique sous l’action de la glycuronyl-transférase. Conjuguée,
elle devient hydrosoluble et peut être éliminée par les selles (sous forme de stercobiline,
qui colore les selles) et par les urines (sous forme d’urobiline, qui colore les urines).
Mais chez le nouveau-né, les possibilités hépatiques de captation et de conjugaison de la
bilirubine sont limitées, ainsi une partie de la bilirubine reste non conjuguée et libre (non
liée à l’albumine).Une fraction se fixe sur les téguments qu’elle colore en jaune :c’est l’ictère.
La partie restante de cette bilirubine non conjuguée libre constitue la partie toxique :
liposoluble, elle a la capacité de se fixer sur les phospholipides des membranes, pénétrant
ainsi dans les cellules où elle agit comme un toxique en lésant les mitochondries et les
systèmes enzymatiques cellulaires. Elle a une affinité particulière pour les cellules des
noyaux gris centraux du cerveau auxquels elle donne une couleur jaune, d’où l’appellation
d’ictère nucléaire. Cette toxicité se traduit par des signes neurologiques immédiats, elle
peut conduire au décès ou à des séquelles neurologiques graves et définitives, telles
surdité, déficit moteur et intellectuel.
La mesure du taux de bilirubine et surtout de bilirubine libre est donc indispensable en cas
d’ictère, afin d’orienter le traitement.
- 3 -
1
/
3
100%