Ascaridiose

1
Ascaridiose
I. Définition :
Parasitose intestinale la plus fréquente dans le monde, l’ascaridiose est causée par un ver
rond, Ascaris lumbricoïdes.
II. L'agent pathogène
Le cycle évolutif d’A.lumbricoïdes est résumé dans le schéma suivant:
1. Morphologie et biologie :
2. Les adultes :

2
Les ascaris adultes vivent de 6 à 18 mois dans le jéjunum où ils ingèrent les particules alimentaires.
Ils migrent facilement et peuvent se retrouver dans différents viscères.
3. L’œuf :
Les œufs ovoïdes sont pondus en très grand nombre dans l’intestin et évacués avec les fèces (stade
1 du cycle parasitaire).
Ces œufs sont très résistants.
4. Les larves :
Après ingestion, la larve contenue dans les œufs embryonnés est libérée dans le tube digestif (stade
3 du cycle parasitaire).
Elle traverse la paroi intestinale et gagne le foie soit par la veine porte soit par le mésentère.
Elle séjourne trois à quatre jours dans le foie, y subissant une mue puis gagne par voie
sanguine le poumon (stades 4 et 5 du cycle parasitaire).
La larve traverse alors la paroi de l’alvéole pulmonaire, remonte l’arbre bronchique jusqu’au pharynx
où habituellement elle est déglutie en direction du tube digestif (stade 6 du cycle parasitaire).
La larve gagne le jéjunum où elle devient adulte (stade 7 du cycle parasitaire).
Les femelles commencent à pondre environ 2 mois après ingestion de l’œuf correspondant.
III. La contamination :
Cette parasitose cosmopolite est favorisée par la chaleur, l’humidité et les risques de contamination
Fécale (utilisation d’engrais humains).
Dans les pays tempérés, les infestations sont pauci parasitaires.

3
IV. La clinique :
Les manifestations cliniques dépendent de l’importance du parasitisme Elles sont
habituellement absentes en cas de pauci-parasitisme.
La phase de migration larvaire (stades 4 à 6 du cycle parasitaire) est marquée par un syndrome de
Löffler : accès de toux accompagnés de fièvre et d’images radiologiques pulmonaires fugaces
asymétriques.
La phase d’état est fréquemment marquée par des troubles digestifs (épisodes diarrhéiques, douleurs
abdominales mal localisées ; exceptionnellement des signes nerveux (irritabilité, troubles du sommeil
voire convulsions).
Des complications chirurgicales peuvent être observées par migration d’adultes donnant des signes
d’angiocholite fébrile, de pancréatite aiguë hémorragique ou d’appendicite.
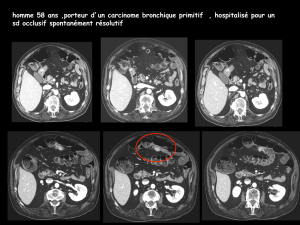
Une occlusion intestinale, un étranglement herniaire, une perforation intestinale peuvent
également être observés.
V. Le diagnostic biologique :
Une hyper éosinophilie apparaît une semaine après la contamination.
Elle atteint un maximum au bout de trois semaines puis décroît progressivement.
A cette hyperéosinophilie est souvent associée une hyperleucocytose.
Un ascaris adulte, facilement identifiable du fait de sa taille permet parfois le diagnostic à partir des
fèces.
Le plus souvent le diagnostic repose sur la découverte des œufs dans les selles.
La quantité d’œufs dépend du nombre de femelles adultes présentes dans le tube digestif.
Des œufs de formes anormales étant observés lors d’infestations mono sexuées femelles.
Le diagnostic sérologique n’a que peu d’intérêt.
VI. La prophylaxie :
1. Hygiène personnelle :
- Lavage des mains, propreté des aliments.
Lutte contre le péril fécal :
- Installation de latrines, égouts, traitement des eaux usées.
- Interdiction des engrais d’origine humaine pour les sols des cultures maraîchères.
2. Points essentiels :
- L’ascaridiose est la parasitose la plus fréquente du monde. Elle est en rapport avec le péril fécal.
- Après ingestion orale d’un œuf mature, la larve traverse la paroi du grêle, gagne le foie puis les
poumons avant de finir d’évoluer dans la lumière de l’intestin grêle.
- Au syndrome de Löffler marquant parfois la phase de migration larvaire, peuvent succéder des
troubles nerveux et exceptionnellement des complications chirurgicales.
- Le diagnostic repose sur l’observation d’une hyperéosinophilie, la présence d’anticorps
spécifiques dès le début de l’infestation puis deux mois après l’émission d’œufs dans les selles.

4
HYMENOLEPIS NANA
Ténia nain
Nom binominal
Le Ténia nain (Hymenolepis nana), est un cestode de très petite taille, parasite strict de l'homme, dont
la présence dans l'intestin grêle de l'enfant et parfois de l'adulte, détermine le tæniasis « infantile »
des régions chaudes.
I. REPARTITION GEOGRAPHIQUE ET IMPORTANCE :
C'est le plus commun des ténias humains ; très fréquent autour de la Méditerranée et dans les régions
chaudes d'Afrique, d'Amérique et d'Asie, il entraine un tæniasis bénin sauf dans les infestations
massives sur terrains déficients.
Morphologie
C'est le plus petit des ténias spécifiques de l'homme : il peut mesurer de 1 à 10 cm, mais sa taille
habituelle, dans les infestations massives, varie de 2 à 3 cm. Son scolex porte quatre ventouses et
une couronne de 20 à 30 crochets sur un rostre rétractile; il est suivi d'un cou très fin et d'une chaîne
d'anneaux plus larges que hauts (au nombre de 100 à 200), à pores génitaux tous du même côté.
II. BIOLOGIE

5
Hymenolepsis nana est le seul ténia de la famille des hyménolépididés à avoir, en grande partie,
affranchi son cycle de l'hôte intermédiaire invertébré qui rendait l'infestation humaine accidentelle et
aléatoire.
Aussi, bien qu'il existe toujours la possibilité d'infestation humaine par déglutition de puces ou de vers
de farine porteurs de cysticercoïdes, le mode habituel de contamination est direct : chez l'enfant
parasité, les anneaux gravides, détachés de la chaîne, sont digérés pendant le transit et libèrent, dans
la lumière intestinale, les œufs caractéristiques : hyalins, limités par une enveloppe externe ovoïde de
50 µ sur 40 µ, ils contiennent un petit embryon hexacanthe entouré par son embryophore en citron
aux pôles munis de filaments flexueux.
Ces œufs, rejetés à l'extérieur avec les selles du porteur, sont déglutis comme souillure des aliments
ou des doigts (auto-réinfestation); dans le duodénum, sous l'action des sucs digestifs, les embryons
hexacanthes sont libérés; ils pénètrent activement dans les villosités duodénales, s'y transforment en
cysticercoïdes, font éclater la villosité, et, libérés, se fixent à la muqueuse jéjunale pour redonner des
vers adultes.
Dans ce cycle, le développement du cysticercoïde au sein des villosités entraîne une réaction
humorale que l'on ne retrouve pas dans le cycle indirect où tout se passe dans la lumière intestinale,
donc "à l'extérieur".
III. CLINIQUE
Une symptomatologie notable n'apparait que dans les infestations massives (500 à plus de 1000
vers). Elle est dominée par les troubles nerveux : convulsions, crises épileptiformes, troubles
méningés.
IV. DIAGNOSTIC
C'est un diagnostic coprologique rendu facile par le nombre et l'aspect très typique des œufs.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%