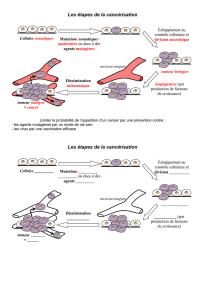
L`origine de la lignée germinale mortalité cellulaire et - iPubli

HYPOTHÈSE
1992 8 695-702
Herman Denis, Jean-Claude Lacroix
D

?
?


1).
0
1
2,

Fus;on
n
 6
6
 7
7
 8
8
1
/
8
100%