Hémostase et chirurgie - Chirurgie

FCC 13 - Hémostase et chirurgie
SOMMAIRE
Président :
C. MEYER (Strasbourg)
Modérateurs :
F. BORIE (Nimes)
E. LERMITE (Angers)
Anticoagulation et chirurgie : quelles recommandations ?
A. STEIB (Strasbourg)
Les Hémostatiques Chirurgicaux
P. BERTAULT PERES (Marseille)
Trucs et astuces
•
Hémostase et chirurgie hépatique
J.-Y. MABRUT (Lyon)
•
Hémostase et chirurgie pelvienne
J.-J. TUECH (Rouen)
•
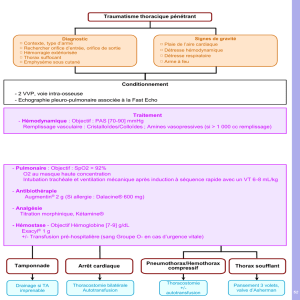
Hémostase et chirurgie thoracique
C. DODDOLI (Marseille)

FCC 13 - Hémostase et chirurgie
ANTICOAGULATION ET CHIRURGIE DIGESTIVE : QUELLES
RECOMMANDATIONS ?
A. Steib, AS. Maes, M. Zappaterra
Service d'Anesthésie-Réanimations Chirurgicales, NHC
Hôpitaux Universitaires de Strasbourg
Les risques hémorragiques et thrombotiques liés à la chirurgie digestive et au terrain du patient (déficits de
l'hémostase, thrombophilie, traitement anticoagulants ou antiagrégants plaquettaires) font l'objet de
discussions et de mises au point régulières.
1) Prévention de la maladie thromboembolique veineuse
Ainsi pour ce qui est du risque thromboembolique, la SFAR, en collaboration avec les différentes sociétés
savantes des spécialités chirurgicales avait publié des recommandations pour la pratique clinique (RPC) en 2005
[1]. Le tableau suivant illustre celles dédiées à la chirurgie digestive
CHIRURGIE DIGESTIVE ET VARICES
Risque chirurgical Risque lié
au patient Recommandations Grade
Faible Varices
Chirurgie abdominale non majeure :
appendice, vésicule non inflammatoire,
proctologie, chirurgie pariétale
- BAT
Rien
A
B
+ HBPM doses modérées ou BAT D
Modéré Dissection étendu et/ou hémorragique
Durée opératoire anormalement
prolongée
Urgences
- HBPM doses modérées ou BAT D
+ HBPM doses modérées ou BAT D
Elevé Chirurgie abdominale majeure : foie,
pancréas, côlon, maladie inflammatoire
ou cancéreuse du tractus digestif
Chirurgie bariatrique
HBPM doses élevées
Avec BAT associés
A
A
BAT : bas antithrombose (contention élastique)
Ces recommandations ont bénéficié d'un toilettage récent ; la mise à jour sera disponible avant la fin de l'année
2011. Deux chapitres ont été rajoutés pour la chirurgie digestive : l'un concerne la chirurgie bariatrique pour
laquelle sont rediscutés la posologie et le nombre d'injections /jour, l'autre s'intéresse plus spécifiquement à la
chirurgie carcinologique avec en ligne de mire une prophylaxie prolongée. Le fondaparinux est proposé dans
certaines indications.
2) Gestion du patient traité par anticoagulants
• 2.1. héparines et AVK
La gestion périopératoire des patients sous anticoagulants est relativement bien codifiée pour les héparines et
les AVK.

FCC 13 - Hémostase et chirurgie
Il est recommandé d'arrêter l'HNF iv, l'HNF sc et les HBPM respectivement 4, 8-12 h, 12-24 h avant l'incision
chirurgicale.
Chez le patient sous AVK, la gestion périopératoire est détaillée dans les recommandations HAS, publiés en
2008 [2]. La dernière prise du traitement a lieu à J-5. Le relais préopératoire n'est pas nécessaire chez les
patients à faible risque [fibrillation atriale (FA) sans accident neurologique ou embolique systématique, maladie
veineuse thromboembolique (MVTE) sans accident récent ou récidive]. A l'inverse un relais est requis chez les
patients a) porteurs d'une valve mécanique, b) atteints de FA avec antécédents d'AIT, d'AVC ou d'embolie
systémique, c) avec accident veineux thromboembolique récent de type TVP proximal ou EP <3mois ou
récidivant. Le relais est débuté 48 h après la dernière dose de fluindione (Préviscan®) avec des doses curatives
et 2 injections par jour (HBPM le plus souvent ou HNF sc) pour les valves et les FA. Une injection curative par
jour est admise pour la MVTE. Le relais par HNF iv est beaucoup plus rarement proposé ; il suppose une
hospitalisation précoce du patient.
Ces doses curatives sont arrêtées 24 h (HBPM) ou 12 h (HBPM sc) avant la chirurgie ; celle-ci est envisageable
pour un INR < 1,5. Ce dernier doit être mesuré la veille de l'intervention. S'il s'avère > 1,5 la correction est
possible grâce à l'administration de 5 mg de vitamine K per os. La reprise du traitement en postopératoire
dépend du risque hémorragique de la chirurgie. Dans les situations à haut risque thrombotique, les doses
curatives devraient théoriquement être reprises au plus tard 48 h après l'acte. Une thromboprophylaxie sera
mise en œuvre précocement dans l'intervalle. Les bas antithromboses ou la CPI sont efficaces en association ou
isolement dans un premier temps en cas de risque hémorragique majeur. La reprise des AVK est tributaire de
celle du transit. Un chevauchement de plusieurs jours entre héparines et AVK est nécessaire, l'objectif étant
d'obtenir un INR thérapeutique (2-3 le plus souvent) stable pour 2 mesures réalisées à 24 h d'intervalle.
Dans le cadre de l'urgence, l'obtention rapide d'une INR < 1,5 est possible par l'injection de CCP (concentré de
complexe prothrombinique = PPSB) à raison de 25 UI/kg (F IX) ou 1 ml/kg associé à la vitamine K 5 mg per os iv
pour consolider la correction qui est rapide (< 30 min).
• 2.2. Nouveaux anticoagulants oraux
De nouveaux anticoagulants oraux destinés à remplacer progressivement les AVK sont en cours d'évaluation et
de mise sur le marché. Ils ont une action ciblée antiIIa (dabigatran = Pradaxa®) ou antiXa (rivaroxaban =
Xarelto®, apixaban =Eliquis®). Les trois médicaments cités ont fait l'objet d'études dans la FA mais aussi dans
d'autres pathologies cardiovasculaires (syndrome coronarien, thrombose veineuse constituée…). Ils ont
l'avantage de ne nécessiter aucune surveillance biologique et n'induisent pas de TIH. Cependant, il existe une
grande variation interindividuelle et on ne dispose pas d'antidotes spécifiques pour reverser rapidement leurs
effets contrairement aux AVK. Afin d'anticiper les problèmes de gestion périopératoire susceptibles de se poser
dans un avenir proche, un groupe d'expert a rédigé des propositions se calquant sur celles des AVK [3].
Paramètres pharmacocinétique des AOD chez les patients en fibrillation atriale

FCC 13 - Hémostase et chirurgie
Cible Dose (mg) Tmax (h) Elimination
T1/2
élimination
(h)
dialysable
Dabigatran
(Pradaxa®)
Anti-IIa 110/150
(2x/j)
2 Fécal 20%
Rénal 80%
14-17 Oui
Rivaroxaban
(Xarelto®)
Anti-Xa 20 (1x/j) 2-4 Fécal 65%
Rénal 33%
7-13 Non
Apixaban
(Eliquis®)
Anto-Xa 5/2,5 (2x/j) 3-4 Fécal 75%
Rénal 25%
8-15 Non
Il est proposé d'interrompre le traitement à J-5. En cas de relais (risque thromboembolique élevé défini pour
les patients sous AVK), le traitement par héparine sera initié 12 h (si 2 prises par jour) ou 24 h (si 1 prise par
jour) après la dernière prise de l'anticoagulant oral. En postopératoire l'effet anticoagulant est obtenu en
quelques heures, contrairement aux AVK. Il ne doit pas y avoir chevauchement avec le traitement par héparine
en cas de relais. Le traitement oral sera repris 12 h après la dernière administration sous cutanée d'HBPM,
lorsque le risque hémorragique est considéré comme contrôlé.
En situation d'urgence, il est souhaitable d'attendre 1 ou 2 T1/2 vies d'élimination du médicament si ce délai ne
compromet pas le pronostic du patient. La normalisation du temps de thrombine (antiIIa) ou l'absence
mesurée d'activité antiXa peuvent aider à la "programmation" idéale de l'urgence. Le bénéfice-risque des
agents de réversion non spécifiques ( CCP, F VII a) reste à évaluer.
En conclusion, la gestion des médicaments de l’hémostase en période périopératoire relève d’une concertation
entre les différents partenaires impliqués dans la prise en charge du patient (chirurgiens, anesthésistes,
cardiologues..). Elle bénéficie d’un support rationnel par le biais de recommandations et d’avis d’experts
modulés au cours du temps par l’expérience acquise.
Références
1) SFAR : Prévention de la maladie thromboembolique veineuse périopératoire et obstétricale RPC 2005
www.sfar.org
2) GEHT : HAS 2008 Recommandations. Prise en charge des surdosages en antivitamines des situations à
risque hémorragique et des accidents hémorragiques chez les patients traités par antivitamines K en
ville et en milieu hospitalier.
3) Sié P, Samama CM, Godier A, Rosencher N, Steib A, Llau JV, Van der Linder P, Pernod G, Lecompte T,
Goin-Thibault I, Abaladejo P. Chirurgies et actes invasifs chez les patients traités au long cours parun
anticoagulant oral anti-IIa ou anti-Xa direct. Propositions du groupe d'intérêt en hémostase
périopératoire (GIHP) et du Groupe d'études sur l'hémostase et la thrombose (GEHT). Ann Fr Anesth
Réanim 2011; 30:645-650

FCC 13 - Hémostase et chirurgie
Les Hémostatiques Chirurgicaux
Bertault Peres
Marseille
Email : Pierre.BERTAULT-PERE[email protected]
Définition
Les hémostatiques chirurgicaux sont des dispositifs médicaux ou des médicaments dont le but est d’améliorer
l’hémostase lors d’interventions chirurgicales, lorsque les techniques conventionnelles sont insuffisantes. Ils
sont donc indiqués en seconde intention. De nombreux facteurs vont influer sur la fréquence de leur utilisation
comme, le type de chirurgie, la voie d’abord, l’expérience du chirurgien, l’état du patient, les anomalies de
l’hémostase, naturelles ou iatrogènes.
Classification
Plusieurs classifications des produits d’hémostase sont possibles, de part leur statut réglementaires (dispositif
médical ou médicament), leur présentation, leur origine, leurs indications, la spécificité de leur action sur la
coagulation ou pas leur capacité d’hémostase et ou d’étanchéité.(Tableau 1)
Nous choisirons une classification en fonction de l’origine des produits.
Origine végétale
Algostéril
Il s’agit d’un alginate, c’est le seul ayant une indication en chirurgie. C’est un polysaccharide naturel provenant
d’algues brunes. Les alginates sont composés de 2 monomère l’acide D-mannuronique et l’acide guluronique
reliés par des liaisons béta 1-4 glycosidiques. Il n’est pas résorbable. Il se présente sous forme de compresse, et
de mèches stériles. C’est un dispositif prêt à l’emploi qui se conserve à température ambiante.
Surgicel
Il s’agit de cellulose. C’est un polysaccharide naturel provenant du bois. il est extrudé puis tissé. Il est
résorbable. Il se présente sous forme de compresse de grammage variable 100 g/m2 : Surgicel, 200 g /m2 :
Surgicel 2. Enfin le Surgicel fibrillaire 300 g/m2 composé de 7 couches non tissées. C’est un dispositif prêt à
l’emploi qui se conserve à température ambiante.
Hemostase MPH
Polysaccharide d’origine végétal résorbable se présentant sous forme particules sphériques microporeuses et
hydrophiles .Il se présente sous forme de poudre conservation à température ambiante.
L’action sur l’hémostase de ces trois produits est à plusieurs niveaux :
Echange d’ion calcium qui est un maillon indispensable de la coagulation.
Formation d’un gel compressif et blocage mécanique du flux
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%