HHV-6 - Infectiologie

L’
L’herpèsvirus
herpèsvirus humain de
humain de
type 6
type 6 (HHV
(HHV-
-6) :
6) :
ce méconnu
ce méconnu
Pr
Pr S.
S. Rogez
Rogez
GERICCO, 26/03/10
GERICCO, 26/03/10

D
Dé
écouvert en 1986
couvert en 1986
Lymphocytes de 6 patients :
Lymphocytes de 6 patients :
-
-lymphoprolif
lymphoprolifé
érations
rations
-
-2 HIV+
2 HIV+
nomm
nommé
éHBLV
HBLV
Microscopie
Microscopie é
électronique :
lectronique : herp
herpè
èsvirus
svirus
tropisme T
tropisme T
HHV
HHV-
-6
6
Proche du cytom
Proche du cytomé
égalovirus
galovirus
Etudes g
Etudes gé
énomiques et antig
nomiques et antigé
éniques
niques
2 variants : A et B
2 variants : A et B

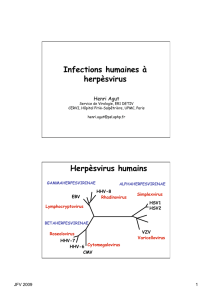
Famille
Famille Herpesviridae
Herpesviridae : > 100 esp
: > 100 espè
èces
ces
8
8 esp
espè
èces strictement humaines
ces strictement humaines
α
αα
α
α
αα
α
-
-herpesvirinae
herpesvirinae
herpes simplex virus type 1 : HSV
herpes simplex virus type 1 : HSV-
-1
1
herpes simplex virus type 2 : HSV
herpes simplex virus type 2 : HSV-
-2
2
virus de la varicelle et du zona : VZV
virus de la varicelle et du zona : VZV
β
ββ
β
β
ββ
β
-
-herpesvirinae
herpesvirinae
cytom
cytomé
égalovirus : CMV
galovirus : CMV
herp
herpè
ès virus humain de type 6 : HHV
s virus humain de type 6 : HHV-
-6
6
herp
herpè
ès virus humain de type 7 : HHV
s virus humain de type 7 : HHV-
-7
7
γ
γγ
γ
γ
γγ
γ
-
-herpesvirinae
herpesvirinae
virus d
virus d’
’Epstein et Barr : EBV
Epstein et Barr : EBV
herp
herpè
ès virus humain de type 8 : HHV
s virus humain de type 8 : HHV-
-8
8
1 esp
1 espè
èce du singe pathog
ce du singe pathogè
ène pour l
ne pour l’
’homme
homme
virus B du singe : herpes virus
virus B du singe : herpes virus simiae
simiae
Genre
Genre
Roseolovirus
Roseolovirus

G
Gé
énome :
nome :
ADN double brin
ADN double brin
Capside
Capside
icosa
icosaé
édrique
drique
Enveloppe
Enveloppe
Spicules
Spicules
T
Té
égument
gument

90% identité A
90% identité A-
-B
B
DR
L
DR
R
IR
β
ββ
β
(Pellet et Dominguez, 2001)
Génome de l’HHV
Génome de l’HHV-
-6B
6B
Gènes spécifiques
Gènes spécifiques
des
des β
ββ
β
β
ββ
β-
-herpèsvirus
herpèsvirus
(U2
(U2-
-U19)
U19)
7 blocs génomiques
7 blocs génomiques
conservés au sein des
conservés au sein des
herpèsvirus
herpèsvirus
(I
(I-
-VII)
VII)
I II III IV V VI VII
I II III IV V VI VII
Séquences internes
répétées
(R1, R2A-B, R3)
Région répétée
Région répétée
droite 9 kb
droite 9 kb
Région unique
Région unique
144
144 kb
kb
Région répétée
Région répétée
gauche 9 kb
gauche 9 kb
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%