RETENTISSEMENT DE L`ALIMENTATION

ACADEMIE DE VERSAILLES
UNIVERSITE DE VERSAILLES SAINT – QUENTIN EN YVELINES
U F R MEDICALE PARIS-ILE-DE-FRANCE-OUEST
ANNEE 2008 N
e
THESE
POUR LE DIPLOME
D'ETAT DE DOCTEUR EN MEDECINE
PAR
BATCHY Christian
Né le 8 Novembre 1978 à Paris
Présentée et soutenue publiquement le 16 Décembre 2008
RETENTISSEMENT DE L’ALIMENTATION ARTIFICIELLE SUR LA
QUALITE DE VIE
Une étude rétrospective menée sur 59 patients en situation
palliative gériatrique
Président : Professeur Laurent TEILLET
Directeur : Docteur Véronique DAREES

A Monsieur le Professeur Laurent Teillet,
Vous me faites l’honneur de présider ma thèse.
Soyez assuré de ma reconnaissance sincère.
A Monsieur le Professeur Chevallier,
Vous me faites l’honneur de présider mon jury.
Veuillez trouver ici l’expression de mon profond respect
A Monsieur le Docteur Lorin de la Grandmaison,
Vous me faites l’honneur d’être membre de mon jury.
Veuillez trouver ici l’expression de ma gratitude.
A Monsieur le Docteur Chevalier,
Vous me faites l’honneur d’être membre de mon jury.
Soyez assuré de ma reconnaissance.
A Madame le Docteur Stheneur,
Vous me faites l’honneur d’être membre de mon jury.
Recevez le témoignage de ma grande considération.
A Madame le Docteur Véronique Darees,
Tu as accepté de diriger l’élaboration de cette thèse.
Trouve ici l’assurance de ma sincère reconnaissance pour la disponibilité, le
soutien, et l’amitié dont tu as fait preuve.
A Monsieur le Docteur Henri-Pierre Cornu,
Merci de m’avoir permis de réaliser ce travail au sein de votre service,
Merci de m’avoir permis de découvrir les « Soins Palliatifs »,
Soyez assuré de ma reconnaissance et de mon plus profond respect.

3
Remerciements
A tous les professeurs de la faculté de médecine PIFO,
A tous les « maîtres de stage » qui m’ont accompagné tout au long de ces
années, et m’ont aidé à progresser
Aux divers membres des équipes paramédicales rencontrés sur mes différents
lieux de stages, en particulier l’équipe de l’UMPG de l’hôpital René Muret,
A mes amis, tout particulièrement Thierry D, Mouloud, et Youcef,
A ma famille,
A mon neveu Mickaël,
A mes sœurs Nelly et Elia,
A mon frère Freddy,
A ma grand-mère Marie (96 ans !!!),
A mon père Jacques,
A ma mère Claudette
A « ma » Joëlle,
A Liya,
A Dieu.

4
TABLEDESMATIERES
INTRODUCTION ........................................................................................................................................7
I. GENERALITES:Soinspalliatifs,Dénutrition,SymptomesetAssistancenutritionnelle.........9
I.1DEFINITIONSETCADRELEGISLATIF ......................................................................................................... 9
I.1.1DEFINITIONDESSOINSPALLIATIFS ................................................................................................. 9
I.1.2CADREJURIDIQUEENCADRANTLESSOINSPALLIATIFS ................................................................ 11
I.1.3LOILEONETTI................................................................................................................................. 12
I.1.4LAPERSONNEDECONFIANCE....................................................................................................... 13
I.2SPECIFICITESDESSOINSPALLIATIFS ...................................................................................................... 14
I.2.1LESPHASESDELAFINDEVIE ........................................................................................................ 14
I.2.2LESSOINSPALLIATIFSGERIATRIQUES ........................................................................................... 15
I.3LADENUTRITION .................................................................................................................................... 16
I.3.1DEFINITIONS.................................................................................................................................. 16
I.3.2PHYSIOPATHOLOGIE...................................................................................................................... 17
I.3.3EVALUATIONDELADENUTRITION................................................................................................ 17
I.3.4RETENTISSEMENTDELADENUTRITION ........................................................................................ 18
I.3.4.1Atteintesglobales ................................................................................................................ 18
I.3.4.2Atteintesspécifiques ........................................................................................................... 19
I.3.4.3Lacachexie:conséquencedeladénutrition....................................................................... 20
I.4SYMPTOMESETALIMENTATIONENSOINSPALLIATIFS ........................................................................ 21
I.4.1DONNEESDESETUDES .................................................................................................................. 22
I.4.2ANOREXIE ...................................................................................................................................... 22
I.4.3LADOULEUR.................................................................................................................................. 23
I.4.4SYMPTOMESRESPIRATOIRES........................................................................................................ 24
I.4.4.1Dyspnée ............................................................................................................................... 24
I.4.4.2Encombrementbronchiqueetrâlesd’agonie ..................................................................... 24
I.4.5NAUSEESETVOMISSEMENTS ....................................................................................................... 25
I.4.6CONSTIPATION .............................................................................................................................. 25
I.4.7CONFUSION................................................................................................................................... 26
I.4.8LESALTERATIONSDEL’ETATBUCCAL ........................................................................................... 26
I.5LADESHYDRATATION ............................................................................................................................ 27
I.5.1PHYSIOLOGIEDELADESHYDRATATION ........................................................................................ 27
I.5.2EVOLUTIONDUMETABOLISMEHYDRIQUEAVECL’AGE............................................................... 28
I.5.3LESSIGNESCLINIQUESDEDESHYDRATATION .............................................................................. 28
I.5.4LESSIGNESBIOLOGIQUESDEDESHYDRATATION ......................................................................... 28

5
I.5.5CONSEQUENCESDELADESHYDRATATION ................................................................................... 29
I.6ASSISTANCENUTRITIONNELLECHEZLESMALADESENPHASEPALLIATIVE ......................................... 30
I.6.1MOYENSETTECHNIQUESDEPRISEENCHARGENUTRITIONNELLE.............................................. 30
I.6.1.1Alimentationorale............................................................................................................... 30
I.6.1.2Alimentationartificielle ....................................................................................................... 32
I.6.1.2.1Nutritionentérale(NE) ................................................................................................... 32
I.6.1.2.2Nutritionparentérale...................................................................................................... 35
I.6.1.3Supportpsychologique ........................................................................................................ 37
I.6.2FACTEURSD’AIDEALAPRISEDEDECISION .................................................................................. 38
I.6.2.1Lesdirectivesdespatients................................................................................................... 38
I.6.2.2Analyseobjectivedessymptômesressentisparlepatient ................................................. 38
I.6.2.3Duréeprévisibledesurvie ................................................................................................... 38
I.6.2.3.1Lesscoresfonctionnels ................................................................................................... 38
I.6.2.3.2Lesparamètresbiologiques ............................................................................................ 39
I.6.2.4Environnementfamilial,rôlesocialetcontextepsychologique.......................................... 40
I.6.2.5Croyancesreligieuses........................................................................................................... 40
I.6.3LES“BONNESPRATIQUES”POURLAPRISEDEDECISION ............................................................. 41
I.6.3.1Unedécisionpartagée......................................................................................................... 41
I.6.3.2Lesguidesderecommandations ......................................................................................... 41
II. MATERIELETMETHODES................................................................................................................45
II.1METHODEDESELECTIONDESPATIENTS ................................................................................................ 45
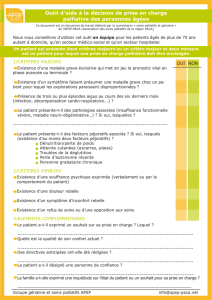
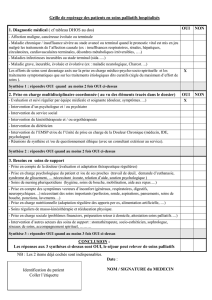
II.2OUTILSD’OBSERVATION ......................................................................................................................... 45
II.3METHODED’EVALUATION ...................................................................................................................... 50
II.4ANALYSESTATISTIQUE ............................................................................................................................ 50
II.5RECHERCHEBIBLIOGRAPHIQUE.............................................................................................................. 50
III. RESULTATS .........................................................................................................................................51
III.1DONNEESGENERALES ....................................................................................................................... 51
III.1.1AGEETSEXE .................................................................................................................................. 51
III.1.2LESPATHOLOGIES ......................................................................................................................... 52
III.1.3NOMINATIOND’UNEPERSONNEDECONFIANCEETDIRECTIVESANTICIPEES ............................. 53
III.2CARACTERISTIQUESGENERALESDESPATIENTSDES3GROUPES .................................................... 53
III.2.1DONNEESGENERALES ................................................................................................................... 53
III.2.2ETATCOGNITIF .............................................................................................................................. 54
III.2.3ETATBUCCAL................................................................................................................................. 55
III.2.4AUTONOMIE.................................................................................................................................. 55
III.2.5CARACTERISTIQUESCLINIQUESAL’ENTREE ................................................................................. 56
III.2.6ETATNUTRITIONNELAL’ENTREE.................................................................................................. 57
III.2.7REPARTITIONDESMODESD’HYDRATATIONSELONLESGROUPES .............................................. 57
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
1
/
99
100%