Formulaire de notification d`incidents

Formulaire de notification d’incidents
avec des dispositifs médicaux de
diagnostic in vitro (DIV)
- pour utilisateurs -
Cfr. Medical Devices Vigilance System
(MEDDEV 2.12-1 rev. 7 )
1. Autorité Compétente Belge relative aux dispositifs médicaux de diagnostic in vitro
Biologie Clinique - Klinische Biologie
Institut Scientifique de Santé Publique - Wetenschappelijk Instituut Volksgezondheid
Rue Juliette Wytsmanstraat 14 - 1050 Bruxelles/ Brussel
Tel: ++32 (0) 2 642 50 40
Fax: ++32 (0) 2 642 56 45
Mail: [email protected]
www.wiv-isp.be
Date d’envoi de ce rapport
Référence attribuée à cet incident par le fabricant (si d’application)
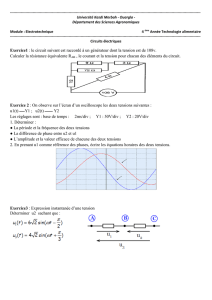
Classification de l’incident
la mort ou la dégradation grave de l'état de santé d'un patient, d'un utilisateur ou d'autres
personnes
Dommages indirects à un patient suite à une décision médicale, ou action entreprise - ou non
entreprise - provenant d’informations obtenues avec un DIV, et menant par exemple à:
- un diagnostic erroné
- un diagnostic tardif
- un traitement inapproprié
- un traitement différé
- une charge ou des analyses supplémentaire(s) pour le patient
- une transfusion ou une transplantation de matériel inapproprié
2 Données concernant le fournisseur de cette information
Contact
Fonction
Nom de l’institut ou du laboratoire
Adresse
N° de téléphone
N° de fax
E-mail

3 Données concernant le fabricant de ce DIV
Nom du fabricant
Personne de contact auprès du fabricant
N° de téléphone
N° de fax
E-mail
4 Identification du DIV faisant l’objet de l’incident
Nom commercial du DIV
Modèle et/ou numéro de catalogue
Numéro(s) de série et/ou numéro(s) de lot
Numéro de la version du logiciel (si d’application)
Date de production et/ou de péremption
Accessoires et/ou produits associés (si d’application)
Numéro d’identification de l’organisme notifié:
les 4 chiffres sous le signe CE (si disponible)
5 Information sur l’incident
Référence attribué à cet incident par l’institut/laboratoire (si d’application)
Date à laquelle le fabricant a été informé
Date de l’incident
Description de l’incident (le plus élaboré possible)
Conséquences pour le patient, l’utilisateur ou un tiers
Nombre de patients, d’utilisateurs ou de tiers concernés par l’incident
Nombre de DIV concernés par l’incident
Le(s) DIV concerné(s) a/ont été(s) conservé(s) et se trouve(nt):

Au moment de l’incident le(s) DIV concerné(s) était utilisé par
un utilisateur professionnel
un patient
autre; veuillez préciser:
6 Information patient (si pertinente)
Age du patient au moment de l’incident
Sexe du patient
F H
Poids en kilogrammes
7 Actions correctives entreprises par l’institution
Actions correctives ou remédiantes vis-à-vis du patient effectuées par l’institution / laboratoire
Autre actions (correctives) entreprises par l’institution
8 Réponse du fabricant du DIV
Première analyse effectuée par le fabricant
Actions initiales correctives/préventives effectuées par le fabricant
9 Autre information
Je confirme que l’information ci-dessus reflète la réalité des faits et est la plus complète possible.
Signature
Nom
Date
1
/
3
100%