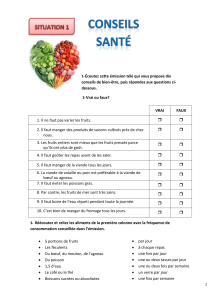
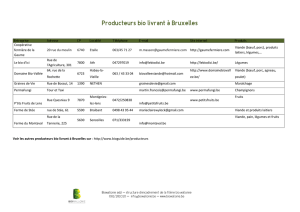
pratique quotidienne À propos de deux cas de trichinellose à

pratique quotidienne
À propos de deux cas de trichinellose
àTrichinella britovi
About two cases of trichinellosis caused by Trichinella britovi
T. Gaillard
1
C. Martinaud
1
S. Kérébel
2
G. Cellarier
2
Y. Muzellec
1
P. Brisou
1
1
Service de biologie médicale,
2
Service de pathologie cardiovasculaire,
Hôpital d’Instruction des Armées Sainte
Anne, Toulon
Article reçu le 13 décembre 2006,
accepté le 8 février 2007
Résumé.La trichinellose ou trichinose est une zoonose cosmopolite due à un
nématode monoxène (un seul hôte pour son développement), du genre Trichi-
nella dont la principale espèce est T. spiralis. C’est une endozootie, qui
s’exprime chez l’homme sous forme de cas sporadiques, de petites épidémies,
et parfois d’endémie, après consommation de viande contenant des larves
encapsulées. Les auteurs rapportent deux cas de trichinellose à Trichinella
britovi dont une myocardite, dans le cadre d’une petite épidémie survenue
après la consommation de viande de sanglier.
Mots clés :Trichinella, trichinellose, Trichinella britovi, myocardite
Abstract.Trichinellosis is a cosmopolitan zoonosis due to a nematode thread-
worm, Trichinella, essentially Trichinella spiralis. Human cases mostly appea-
red sporadically, sometimes endemically, related with consumption of larva
stinking meat. We report two cases of trichinellosis, including a myocarditis,
caused by Trichinella britovi after consumption of frozen wild boar meat.
Key words:Trichinella, trichinellosis, Trichinella britovi, myocarditis
L’observation
Début juillet 2006, deux habitants domiciliés dans le cen-
tre du département du Var heurtent un sanglier avec leur
véhicule, à proximité d’un village de la forêt des Maures.
L’animal est ramené au domicile de l’un d’entre eux : une
partie de la viande est congelée, l’autre préparée en salai-
son. Le 10 juillet 2006, l’ensemble des patients consomme
une partie de la viande en salaison. Quatre personnes sont
atteintes, deux sont hospitalisées dans notre structure le
26 juillet 2006.
Le premier patient, âgé de 41 ans, sans antécédent notable,
entre aux urgences avec une fièvre à 40 °C, des myalgies
diffuses et des céphalées apparues depuis 5 jours. L’exa-
men clinique retrouve un œdème facial à prédominance
périorbitaire. Le reste de l’examen clinique est normal,
notamment neurologique et cardiaque. L’électrocardio-
gramme (ECG) effectué à titre systématique ne retrouve
pas de modifications évocatrices d’une atteinte cardiaque.
Le bilan biologique initial montre une absence d’hyperéo-
sinophilie (leucocytose à 7,8 × 10
9
/L et polynucléaires
éosinophiles à 0,6 × 10
9
/L), un syndrome inflammatoire
discret (CRP à 16,9 mg/L) et une augmentation modérée
des marqueurs musculaires (créatinine phosphokinase (CPK)
à 445 UI/L, lacticodéshydrogénase (LDH) à 257 UI/L et
myoglobine à 94 lg/L).
Le prélèvement effectué à l’entrée du patient est resté
négatif pour la sérologie de dépistage de la trichinellose
par Elisa.
Un traitement par Zentel
®
400 mg (1 comprimé matin et
soir) est entrepris sur un faisceau d’arguments cliniques et
épidémiologiques. Il est poursuivi pendant 14 jours.
L’évolution est marquée par l’apparition d’une hyperéosi-
nophilie à 1,8 × 10
9
/L au 3
e
jour de Zentel
®
et par une
lente régression des signes fonctionnels. Une visite au
2
e
mois après sa sortie de l’hôpital permet de constater
une guérison clinique et biologique.
abc
Ann Biol Clin 2007 ; 65 (3) : 308-12
doi: 10.1684/abc.2007.0128
Ann Biol Clin, vol. 65, n° 3, mai-juin 2007308
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

Le deuxième patient, âgé de 36 ans, sans antécédents
médicaux et chirurgicaux, est adressé au service de car-
diologie pour des modifications électrocardiographiques
observées au cours d’une trichinellose de découverte
récente.
Dans les jours précédents, il a présenté de violentes dou-
leurs abdominales, une diarrhée aqueuse et des vomisse-
ments dans un contexte fébrile à 40 °C. En quelques jours,
l’évolution se fait vers une altération de l’état général avec
une fièvre en plateau à 39 °C et des myalgies invalidantes.
L’examen clinique mettait en évidence un œdème de la
face avec conjonctivite bilatérale. Devant ces symptômes
et l’existence d’une petite épidémie après consommation
de viande de sanglier non cuite, le diagnostic de trichinel-
lose était évoqué.
À l’entrée, le 26 juillet 2006, le patient est apyrétique, les
douleurs ont disparu, l’examen clinique est normal. Sur le
plan cardiaque, on retrouve une hémodynamique stable
sans signes d’insuffisance cardiaque, les bruits du cœur
sont réguliers sans souffle ni bruits surajoutés. Le bilan
biologique initial montre une hyperleucocytose
(24,5 × 10
9
/L) avec hyperéosinophilie (12,0 × 10
9
/L), un
syndrome inflammatoire très discret (CRP à 11,7 mg/L),
une augmentation modérée des marqueurs musculaires
(CPK à 408 UI/L, LDH à 363 UI/L et myoglobine à
178 lg/L) et de la troponine Ic (0,33 lg/L).
Le diagnostic étiologique de trichinellose évoqué sur les
circonstances épidémiologiques, les signes cliniques et
biologiques est confirmé par la sérologie. Le prélèvement
effectué le 28 juillet 2006 est positif en technique de
dépistage Elisa, puis confirmé par western blot qui conclut
à la présence de bandes à 43-44 et 64 kDa en faveur d’une
infection à Trichinella spp.
L’ECG s’inscrit en rythme sinusal, régulier, sans trouble
de la conduction. Il existe des troubles de la repolarisation
en territoire latéral, troubles non présents sur un tracé de
référence réalisé un an auparavant. L’échocardiographie
trans-thoracique objective une fonction ventriculaire gau-
che normale avec une cinétique globale et segmentaire
homogène, sans épanchement. Il n’existe pas de valvulo-
pathie, ni d’hypertension artérielle pulmonaire. L’enregis-
trement sur 24 heures selon la méthode de Holter retrouve
un rythme sinusal permanent, l’absence de trouble du
rythme, de trouble conductif ou de pause.
Devant les modifications de l’ECG de repos et l’élévation
de la troponine Ic, une imagerie par résonance magnétique
(IRM) cardiaque est pratiquée. Cet examen confirme
l’existence d’une fonction ventriculaire gauche normale
(fraction d’éjection du ventricule gauche à 60 %, cinétique
globale et segmentaire normales) et l’absence de décolle-
ment péricardique. Dix minutes après injection de gadoli-
nium, la réalisation de séquences tardives met en évidence
un rehaussement sous-épicardique en bande au niveau du
segment inféro-latéral.
Un traitement par Zentel
®
400 mg (1 comprimé matin et
soir) est prescrit pour 15 jours. Une corticothérapie par
prednisolone à posologie dégressive est associée sur une
période de 20 jours (20 mg/j les cinq premiers jours,
15 mg/j les cinq jours suivants puis 10 et 5 mg). Une IRM
cardiaque de contrôle, programmée deux mois après le
début des signes cliniques, objective la guérison.
À notre connaissance, les deux autres convives atteints ont
eu des manifestations similaires à notre premier cas, sans
augmentation de troponine Ic, ni anomalies de l’ECG.
Le diagnostic d’espèce a été porté sur un échantillon de
salaison par l’Afssa (Agence française de sécurité sani-
taire des aliments) d’Alfort. L’analyse biologique vétéri-
naire conclut à la présence de5à10larves encapsulées de
Trichinella britovi par gramme de viande.
Le point de vue du biologiste
Les trichines sont des nématodes vivipares des mammifè-
res omnivores et carnivores. La trichinellose animale est
cosmopolite. La distribution des cas humains est liée aux
habitudes alimentaires. En Europe, viande de porc, de
sanglier et de cheval sont les principales sources de conta-
mination [1, 2].
L’infestation par voie digestive succède à la consomma-
tion de viande parasitée, crue ou mal cuite. Les larves
encapsulées sont libérées par la digestion gastrique [3].
Ces larves pénètrent dans l’épithélium intestinal et devien-
nent adultes en 36 heures. Après l’accouplement, les
femelles pénètrent dans la paroi de l’intestin grêle pour y
pondre des embryons qui, par voie lymphatique puis san-
guine, gagnent le cœur gauche et enfin la grande circula-
tion (figure 1). Ces larves longues d’environ 100 lm pénè-
trent dans les muscles striés et atteignent la circulation
capillaire. Les muscles les plus touchés sont les plus irri-
gués, à savoir le diaphragme, les muscles intercostaux, les
muscles du cou, de la gorge et les extrémités des muscles
des membres. Les larves matures s’encapsulent vers le 18
e
jour de l’infection et restent viables des années. C’est
l’absorption du muscle contenant les larves qui est conta-
minante.
L’orientation étiologique s’appuie sur des renseignements
initiaux :
– épidémiologiques tels que la notion de petite épidémie
familiale et la consommation de viande crue ou mal cuite ;
– cliniques devant l’apparition d’un œdème facial fébrile
avec myalgies succédant à des troubles digestifs.
Trichinellose
Ann Biol Clin, vol. 65, n° 3, mai-juin 2007 309
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

L’hyperéosinophilie, principal signe biologique d’orienta-
tion, est précoce, intense et durable. Elle se caractérise par
une apparition dès la phase initiale, avec un pic atteint vers
la 5
e
semaine et un retour à la normale progressif vers la 8
e
ou 10
e
semaine. Le premier patient fait partie de la moitié
des trichinelloses sans hyperéosinophilie à deux semaines,
et son hyperéosinophilie n’est déclenchée que lors de la
lyse des parasites par le traitement antiparasitaire. Le
deuxième patient fait lui partie de ces hyperéosinophilies
massives qui peuvent atteindre 30 × 10
9
/L au pic.
Elle est classiquement accompagnée de l’élévation du
taux des enzymes musculaires : CPK et aldolase essentiel-
lement, LDH et transaminases (Asat et Alat) sont de moin-
dre intérêt. Cette élévation est habituellement précoce et
modérée comme chez nos deux patients.
Le diagnostic étiologique repose en pratique sur la sérolo-
gie parasitaire. Les méthodes utilisées sont les suivantes
[3, 4] :
– des techniques de dépistage : Elisa, immunofluores-
cence indirecte et agglutination de microparticules de
latex, de mise au point récente. Ce sont des techniques
sensibles mais dont la spécificité peut être faible en raison
de la possibilité de réactions croisées avec d’autres hel-
minthiases ou de faux positifs lors de maladies auto-
immunes. Les anticorps actuellement recherchés sont les
IgG. La négativité de notre premier patient au 15
e
jour
d’infestation peut s’expliquer par une séroconversion sou-
vent tardive dans les trichinelloses et ce d’autant que
l’espèce en cause n’est pas Trichinella spiralis et que
l’infestation est vraisemblablement faible. C’est pourquoi
il est important de prélever un sérum précoce et un sérum
tardif 2 semaines après. Les anticorps IgG atteignent en
effet un maximum en 4 mois et persistent ensuite plu-
sieurs années. De toute façon, une sérologie précoce néga-
tive associée à des signes fortement évocateurs ne doit pas
faire éliminer définitivement le diagnostic. La recherche
d’IgA spécifiques dirigées contre les embryons pourrait
permettre une détection précoce de l’infection ;
– des techniques de confirmation : elles sont indispensa-
bles pour gagner en spécificité, le western blot étant la
plus employée. Les méthodes d’amplification génomique
permettent un diagnostic précoce mais sont réservées aux
laboratoires de recherche.
En pathologie humaine, le diagnostic de certitude repose
sur la découverte des larves dans une biopsie musculaire.
Les larves sont enroulées sur elles-mêmes à l’intérieur
d’une cavité généralement ovoïde.
Le point de vue du clinicien
Cliniquement, l’expression d’une trichinellose est très
variable, dépendant étroitement de la dose infestante ingé-
rée. Elle peut passer inaperçue, être bénigne, modérément
sévère ou sévère. Classiquement, l’infection se déroule
selon les phases du cycle parasitaire :
– la phase de migration des larves puis des femelles adul-
tes correspond à un « catarrhe intestinal » marqué par des
diarrhées, des vomissements, des douleurs abdominales
dans un contexte rapidement fébrile ;
– la phase de dissémination larvaire débute entre la 2
e
et la
3
e
semaine après l’infestation. La triade évocatrice associe
une fièvre en plateau à 39-40 °C, des myalgies diffuses et
un œdème de la face et périorbitaire bilatéral donnant un
aspect de « maladie des grosses têtes ». C’est à ce stade
que peuvent survenir les complications notamment neuro-
logiques et cardiaques ;
– la phase d’encapsulation correspond à la convalescence,
à partir de la 3
e
ou 4
e
semaine après l’infestation. La
régression des myalgies et de l’asthénie est toujours lente.
Les manifestations cardiaques sont peu décrites. Pourtant,
les études font état d’un taux d’incidence variant entre 21
et 75 %. Les trois tuniques peuvent être atteintes, avec une
prédominance des myocardites, puis des péricardites, et de
rares cas d’endocardites. La symptomatologie clinique est
souvent absente comme dans notre observation. L’alerte
est donnée par l’ECG qui doit être effectué en systémati-
que devant toute suspicion de trichinellose. Les perturba-
tions sont décrites dans près de 50 % des cas, non spécifi-
ques, la plus fréquente concerne la repolarisation
ventriculaire comme dans notre observation. L’élévation
2
3
4
5
5
2
1
11
3
4
2
3
4
5
2
3
i
4
5
did
id
id
iPhase d’infestation
Rongeurs
Suidés
Larves enkystées dans
les muscles striés
Larves déposées dans
la muqueuse de l’intestin grêle
Adultes dans
l’intestin grêle
Ingestion de
viande infestée
Ingestion de
viande mal cuite
Larves enkystées
dans les muscles
striés
Phase de diagnostic
d
Larves relarguées
dans l’intestion grêle
CarnivorismeCarnivorisme
Circulation
Figure 1. Le cycle du parasite (d’après CDC Atlanta : http://www.
dpd.cdc.gov/dpdx).
pratique quotidienne
Ann Biol Clin, vol. 65, n° 3, mai-juin 2007310
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

de la troponine Ic n’oriente pas nécessairement vers une
myocardite, puisqu’on l’observe également dans les péri-
cardites. Cette élévation est inconstante, souvent modérée,
et contrairement aux syndromes coronariens aigus, n’a pas
valeur pronostique. Il semble néanmoins justifié de la
prescrire devant toute trichinellose à l’instar de l’ECG.
La difficulté réside dans la confirmation du diagnostic de
myocardite. L’IRM cardiaque semble apporter des argu-
ments essentiels. L’association de cette technique à
l’injection de gadolinium permet une parfaite analyse des
cavités cardiaques et la visualisation de zones de rehausse-
ment tardif au sein du myocarde. La prise de contraste
après diffusion du gadolinium est liée à l’augmentation de
la perméabilité capillaire résultant de l’inflammation et de
la rupture membranaire des myocytes. Au cours d’une
myocardite, elle est typiquement focale, plus ou moins
nodulaire au stade précoce de la maladie avec une ten-
dance à l’extension au cours de la première semaine. Elle
prédomine dans la paroi latérale du ventricule gauche
mais peut intéresser le septum.
Un dernier argument en faveur d’une myocardite parasi-
taire est l’évolution rapidement résolutive de la maladie
sous albendazole et corticothérapie. La précocité de mise
en route du traitement explique la discrétion des signes
biologiques, électriques et morphologiques de notre
observation.
Commentaires
La trichinellose est une maladie rare en France qui
s’exprime principalement sous forme de petites épidé-
mies, ce qui est le cas dans notre observation. Les cas de
trichinellose autochtone ont été estimés à plus de 2 400
depuis 1975, le nombre de cas signalés par le Centre
national de référence (CNR des Trichinella - Université
Paris-Descartes - Faculté de médecine - Hôpital Cochin –
Paris) étant en augmentation depuis le début des années
2000.
La consommation de viande de sanglier reste à l’origine
de petites épidémies parmi les familles de chasseurs.
Depuis 1975, huit épidémies sont survenues chez des
consommateurs de viande de cheval, situation paradoxale
compte tenu du régime herbivore de ces animaux.
Parmi les huit espèces [2, 5] connues de trichine, trois sont
retrouvées en France : Trichinella spiralis (cosmopolite),
Trichinella britovi (faune sauvage en zone de moyenne
montagne : altitude supérieure à 500 m) et Trichinella
pseudospiralis (espèce inféodée aux espèces aviaires). Tri-
chinella britovi, à l’origine de contaminations en Europe
du Sud, semble progresser depuis l’Espagne et l’Italie
avec l’apparition de cas ces dernières années dans les
Alpes maritimes [6, 7] et le Var. Dans le Var, coexistent
actuellement T. britovi et T. spiralis.
Notre observation souligne l’intérêt de procéder à un
interrogatoire minutieux à la recherche d’une consomma-
tion de viande sauvage crue ou peu cuite dans le mois
précédant la survenue des symptômes et de réaliser une
numération de la formule sanguine devant un tableau cli-
nique associant une fièvre, un œdème et des myalgies
intenses.
Lorsque l’étiologie de trichinellose est évoquée, il est
recommandé de prescrire un ECG et le dosage de la tropo-
nine Ic, et ce même en l’absence de tout signe cardiaque.
Une anomalie de l’un de ces deux examens impose une
consultation et un suivi en milieu spécialisé.
Le traitement de la trichinellose repose sur l’administra-
tion d’albendazole durant 14 jours ; cette molécule est
efficace et bien tolérée, et n’impose pas de surveillance
particulière, si ce n’est la réalisation d’une numération de
la formule sanguine à huit semaines pour évaluer l’éosino-
philie.
Conclusion
La trichinellose humaine doit être considérée comme une
maladie réémergente à travers le monde. Des mesures
simples de prévention existent. Il faut en informer les
consommateurs de viande de porc ou d’animaux sauvages,
en les incitant à [8] :
– respecter les règles minimales de cuisson, en sachant
que les larves sont détruites immédiatement lorsque la
température à cœur atteint 63 °C ;
– respecter les règles de congélation des pièces de viande
d’animaux sauvages. Les espèces Trichinella britovi et
surtout Trichinella nativa sont connues pour résister à la
congélation. Il est nécessaire pour obtenir la perte de leur
pouvoir infestant que les morceaux de viande soient d’une
épaisseur maximale de 15 cm et soient congelés au moins
4 semainesà–20°C.
Références
1. Dupouy–Camet J, Ancelle T. Zoonoses parasitaires transmises par la
chair animale en France. La lettre de l’infectiologue 2002 ; 17 : 143-8.
2. Pozio E, Darwin Murell K. Systematics and epidemiology of Trichi-
nella. Adv Parasitol 2006 ; 63 : 367-439.
3. Akisu C, Delibas SB, Ozkoc S, Pozio E. Serodiagnosis of trichinello-
sis : in-house versus commercial ELISA. Parasite 2006 ; 13 : 262-3.
4. De Bruyne A, Vallée I, Ancelle T, et al. Trichinelloses. EMC, Mala-
dies infectieuses 8-517-A-10. Paris : Elsevier Masson, 2006.
Trichinellose
Ann Biol Clin, vol. 65, n° 3, mai-juin 2007 311
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.

5. Pozio E, Zarlenga DS. Recent advances on the taxonomy, systematics
and epidemiology of Trichinella. Int J Parasitol 2005 ; 35 : 1191-204.
6. Gari-Toussaint M, Tieulé N, Baldin J, et al. Trichinellose à Trichinella
britovi dans les Alpes maritimes après consommation de viande de san-
glier congelée, automne 2003. Bulletin épidémiologique hebdomadaire
2004;21:87-8.
7. Gari-Toussaint M, Tieulé N, Baldin J, et al. Human trichinellosis due
to Trichinella britovi in southern France after consumption of frozen
wild boar meat. Euro Surveill 2005 ; 10 : 117-8.
8. Dupouy-Camet J. Trichinellosis : a worlwide zoonosis. Vet Par 2000 ;
43 : 191-200.
pratique quotidienne
Ann Biol Clin, vol. 65, n° 3, mai-juin 2007312
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 26/05/2017.
1
/
5
100%