BC P1 chap 2 cytosque#B316D.ppt [Lecture seule]

Pr Germain TRUGNAN
Faculté de Médecine Pierre et Marie Curie
PCEM1
2005-2006
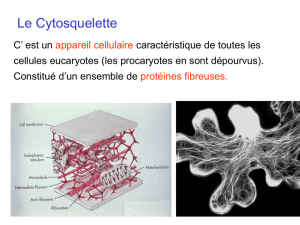
Le cytosquelette
Constituants et dynamique
Biologie cellulaire
Module I
Chapitre 2
1. Présentation du cytosquelette
1.1. Constituants
1.2. Fonctions
2. Les filaments intermédiaires
2.1. Structure,assemblage et diversité
2.2. Fonctions des filaments intermédiaires
3. Les microtubules
3.1. Structure et assemblage
3.2. Protéines associées aux microtubules
3.3. Fonctions du réseau de microtubules
4. Les microfilaments
4.1. Structure et assemblage
4.2. Protéines de liaison à l’actine
4.3. Fonctions du réseau de microfilaments
1.3. Méthodes d’étude du cytosquelette
NB : Les illustrations de ce cours sont adaptées de «
Biologie Moléculaire de la Cellule
», Alberts et col.
et de «
cours de biologie cellulaire
» de P. Cau et R. Seïte
Cours « cytosquelette » : Le plan

microtubules 25 nm
microfilaments 8 nm
Filaments intermédiaires 10 nm
1. Présentation du cytosquelette (1)
1.1. Constituants (1)
1.1.1. Le cytosquelette est composé de trois types principaux de filaments
1.1.2. Chaque type de filament est composé par l’assemblage de monomères spécifiques
microfilaments
actine
microtubules
tubuline
Filaments intermédiaires
kératines
1.1.3. La distribution spatiale et l’organisation de chaque type de réseau de filaments est
particulière.
1. Présentation du cytosquelette (2)
1.1. Constituants (Rappel) (2)
haut Milieu haut
Milieu bas bas
microfilaments microtubules Filaments intermédiaires

1.1.4. De très nombreuses protéines sont associées à ces filaments. Elles orientent et
contrôlent les fonctions du cytosquelette (voir plus loin).
1. Présentation du cytosquelette (3)
1.1. Constituants (3)
1.2. Fonctions
Le cytosquelette assure principalement deux types de fonctions :
* Il permet le maintien ou l’adaptation à l’environnement de la structure cellulaire et le
positionnement des organites intracellulaires
* Il supporte les fonctions motrices de la cellule :
• déplacement des organites et des vésicules (= trafic intracellulaire)
• déplacement cellulaire (= motilité)
La contribution du cytosquelette à ces fonctions
dépend fortement du type de filament et des
protéines qui lui sont associées.
Les différents types de filaments s’associent ou se relayent souvent pour assurer les
fonctions du cytosquelette
Chaque type de filament a des propriétés
spécifiques de résistance à la déformation
déformation
Force déformante
microfilaments
Filaments
intermédiaires
microtubules
L’immunofluorescence … en bref
perméabilisation
1. Présentation du cytosquelette (4)
1.3. Méthodes d’étude du cytosquelette (1)
L’étude du cytosquelette est basée sur des approches morphologiques et biochimiques
(voir cours n°1 et ED).
L’immunocytochimie, et plus particulièrement l’immunofluorescence, des méthodes
particulièrement employées en biologie cellulaire, s’avèrent très utiles (voir images précédentes)
Elles reposent sur l’emploi de marqueurs vitaux ou d’anticorps spécifiques dirigés contre
les constituants du cytosquelette ou les protéines associées.
+
Anticorps dirigé
contre un monomère
de tubuline
Ce «
premier
»
anticorps est produit
dans une espèce A
+
Anticorps dirigé contre les
immunoglobulines de
l’espèce A
Ce «
second
»
anticorps est produit
dans une espèce B
et est «
marqué
»
par un fluorochrome

L’étude de la dynamique du cytosquelette est plus complexe. Elle nécessite souvent
l’introduction de molécules fluorescentes ou marquées dans les cellules.
1. Présentation du cytosquelette (5)
1.3. Méthodes d’étude du cytosquelette (2)
Trois méthodes modernes …
Micro-injection
Micropipette
transfection
liposomes
électroporation
Plaques électriques
Il existe également des drogues qui interfèrent avec la dynamique du cytosquelette.
(exemple : le nocodazole dépolymérise les microtubules)
Les cellules ainsi transformées peuvent être analysées en vidéo-microscopie.
2. Les filaments intermédiaires (1)
2.1. Structure,assemblage et diversité (1)
Les filaments intermédiaires sont des structures fibreuses, compactes et résistantes, formées par
l’association complexe de nombreux monomères
monomère
NH2COOH
Dimère
superenroulé COOH
NH2COOH
48 nm
NH2
Tétramère
(2 dimères étagés)
COOH NH2COOH
NH2COOH
COOH
NH2
NH2
Deux tétramères
superenroulé
Un filament
intermédiaire
de base
10 nm
Un monomère de filament intermédiaire est formé
d’une région centrale très riche en hélices ,
conférant une structure en bâtonnet. Cette région
est également riche en répétition heptade (coil-
coil) favorisant les interactions protéine-protéine

Famille structure localisation
2. Les filaments intermédiaires (2)
2.1. Structure,assemblage et diversité (2)
Il existe une grande diversité de monomères de filaments intermédiaires. Ils sont à l’origine de
filaments dont la localisation et la fonction sont différentes
Kératines
(21 espèces)
épithéliums
Vimentine Cellules d’origine
endodermique
Protéines de
neurofilament Cellules nerveuses
Lamines
nucléaires
Lamina nucléaire
COOH
NH2
répétitions heptades
2. Les filaments intermédiaires (3)
2.2. Fonctions (1)
Elles dépendent essentiellement du type de filament.
Les fonctions des filaments intermédiaires concernent principalement le maintien de
l’architecture cellulaire et tissulaire
Dans les épithéliums, les kératines relient les cellules entre elles par l’intermédiaire des desmosomes.
Les kératines assurent la cohésion et la stabilité mécanique.
Cisaillement cellulaire au
niveau des kératines
déféctueuses
kératines déféctueuses
Lame basale
noyau
Cellules basales de l’épiderme
Peau normale Epidermolyse bulleuse
Mutation sur une kératine
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%