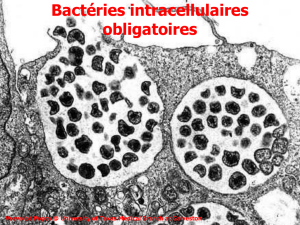
These seb ok A4


.

CONTRIBUTION A L’ETUDE
DES INFECTIONS A
Anaplasma phagocytophilum
CHEZ LES RUMINANTS DOMESTIQUES
THESE
pour obtenir le grade de
DOCTEUR VETERINAIRE
DIPLOME D’ETAT
présentée et soutenue publiquement en 2002
devant l’Université Paul-Sabatier de Toulouse
par
Sébastien, Patrice, Christian CHEVALIER
Né, le 11 juillet 1971 à CHARTRES (Eure-et-Loir)
Directeur de thèse : M. Jean EUZEBY
JURY
PRESIDENT :
Mme Elisabeth ARLET-SUAU
ASSESSEUR :
M. Jean EUZEBY
M. Stéphane BERTAGNOLI
Professeur à l’Université Paul-Sabatier de TOULOUSE
Professeur à l’Ecole Nationale Vétérinaire de TOULOUSE
Maître de Conférences à l’Ecole Nationale Vétérinaire de TOULOUSE
ANNEE 2002 THESE : 2002 - TOU 3 - 4168

.

MINISTERE DE L'AGRICULTURE ET DE LA PECHE
ECOLE NATIONALE VETERINAIRE DE TOULOUSE
Directeur : M. P. DESNOYERS
Directeurs honoraires……. : M. R. FLORIO
M. J. FERNEY
M. G. VAN HAVERBEKE
Professeurs honoraires….. : M A. BRIZARD
M. L. FALIU
M. C. LABIE
M. C. PAVAUX
M. F. LESCURE
M. A. RICO
M. A. CAZIEUX
Mme V. BURGAT
M. D. GRIESS
PROFESSEURS CLASSE EXCEPTIONNELLE
M. CABANIE Paul, Histologie, Anatomie pathologique
M. CHANTAL Jean, Pathologie infectieuse
M. DARRE Roland, Productions animales
M. DORCHIES Philippe, Parasitologie et Maladies Parasitaires
M. GUELFI Jean-François, Pathologie médicale des Equidés et Carnivores
PROFESSEURS 1ère CLASSE
M. AUTEFAGE André, Pathologie chirurgicale
M. BODIN ROZAT DE MANDRES NEGRE Guy, Pathologie générale, Microbiologie, Immunologie
M. BRAUN Jean-Pierre, Physique et Chimie biologiques et médicales
M. DELVERDIER Maxence, Histologie, Anatomie pathologique
M. EECKHOUTTE Michel, Hygiène et Industrie des Denrées Alimentaires d'Origine Animale
M. EUZEBY Jean, Pathologie générale, Microbiologie, Immunologie
M. FRANC Michel, Parasitologie et Maladies Parasitaires
M. MARTINEAU Guy, Pathologie médicale du Bétail et des Animaux de basse-cour
M. MILON Alain, Pathologie générale, Microbiologie, Immunologie
M. PETIT Claude, Pharmacie et Toxicologie
M. REGNIER Alain, Physiopathologie oculaire
M. SAUTET Jean, Anatomie
M. TOUTAIN Pierre-Louis, Physiologie et Thérapeutique
PROFESSEURS 2e CLASSE
Mme BENARD Geneviève, Hygiène et Industrie des Denrées Alimentaires d'Origine Animale
M. BERTHELOT Xavier, Pathologie de la Reproduction
M. CORPET Denis, Science de l'Aliment et Technologies dans les industries agro-alimentaires
M. DUCOS DE LAHITTE Jacques, Parasitologie et Maladies parasitaires
M. ENJALBERT Francis, Alimentation
Mme KOLF-CLAUW Martine, Pharmacie -Toxicologie
M. LEFEBVRE Hervé, Physiologie et Thérapeutique
M. LIGNEREUX Yves, Anatomie
M. PICAVET Dominique, Pathologie infectieuse
M. SCHELCHER François, Pathologie médicale du Bétail et des Animaux de basse-cour
PROFESSEUR ASSOCIE
M. HENROTEAUX Marc, Médecine des carnivores
INGENIEUR DE RECHERCHES
M. TAMZALI Youssef, Clinique équine
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
1
/
83
100%