Archaebactéries et évolution - iPubli

SYNTHÈSE
Carlo Cocito
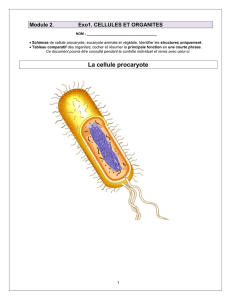
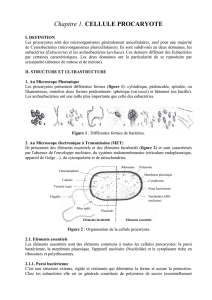
Archaebactéries
et évolution
L

x
x
1
�

2).

m/s

s
 6
6
 7
7
 8
8
 9
9
1
/
9
100%