La Conférence annuelle de TAMEST 2015 sous l`égide du Cancer

Mission pour la Science et la Technologie de l’Ambassade de France aux Etats-Unis
La Conférence annuelle de TAMEST 2015 sous l’égide du Cancer [partie
2/2]
Publié le vendredi 6 février 2015
Voir en ligne : https://www.france-science.org/La-Conference-annuelle-de-TAMEST,4429.html
Cette brève fait suite à une première partie présentant la conférence TAMEST 2015 et abordant différents
aspects de la lutte contre le cancer, tels que l’épidémiologie, la prévention, et la détection précoce. Cette
deuxième partie s’intéresse aux avancées dans la recherche sur le cancer.
Recherche
L’implication des gènes dans l’apparition du cancer a fait l’objet de 4 présentations. L’objectif de cette
recherche sur les gènes causant le cancer ou oncogènes est d’obtenir une vision assez précise des
mécanismes génétiques mis en jeu lors de la prolifération du cancer de manière à pouvoir influencer le cycle
menant au développement de cellules cancéreuses. Et l’un des plus importants avancements dans le
traitement du cancer a été le développement de médicaments qui inhibent des oncogènes. De telles thérapies
ont connu certains succès significatifs et la communauté des chercheurs s’est fortement focalisée sur la
prospection de nouvelles cibles d’oncogènes par la caractérisation génétique et épigénétique massive des
génomes du cancer.
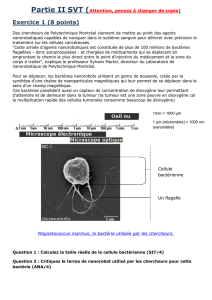
Au cours de la conférence TAMEST 2015, le Dr. James Brugarolas de l’Université du Texas - Centre Médical
du Sud-Ouest a en particulier discuté de ses travaux concernant le cancer du rein qui est diagnostiqué auprès
de plus de 60.000 Américains chaque année [1]. Le Dr. Brugarola s’est intéressé tout particulièrement au plus
commun des cancers du rein, le carcinome à cellules claires (ccRCC pour clear-cell cell carcimona). Ce
cancer est caractérisé par la perte du gène VHL, un gène suppresseur de tumeurs, une catégorie de gènes
qui code les protéines qui limitent la prolifération des cellules. Le groupe du Dr. Burgarolas travaille sur la
relation entre les gènes VHL, BAP1 et PBRM1 trois gènes localisés sur le même région du chromosome 3
(3p). Son groupe a en particulier remarqué que les mutations des gènes BAP1 et PBRM1 étaient anti-corrélés
et que les patients ayant perdu simultanément les gènes VHL et BAP1 ont des cancers bien plus agressifs
que les patients ayant perdu simultanément les gènes VHL et PBRM1. Ils proposent ainsi que les cancers du
rein de type ccRCC débutent par une mutation intra-génique du gène VHL suivie par une perte de (3p) et une
mutation de PBRM1 ou de BAP1. Le Dr. Brugarolas et son groupe de recherche tentent maintenant d’établir la
première classification génétique du cancer du rein de type ccRCC avec l’identification de deux sous-types de
ccRCC ayant des conséquences très différentes pour les patients et ainsi présenter un modèle unifié pour le
développement des cancers du rein de type ccRCC.
Un autre intervenant, le Dr. Frederic de Sauvage, a présenté les recherches de son groupe au sein de
l’entreprise Genentech Inc., membre du groupe Roche, dont le siège social est localisé en Californie [2]. Le
Dr. de Sauvage et son groupe travaillent sur l’influence de la voie de signalisation nommée Hedgehog sur un
type de cancer de la peau, le carcinome basocellulaire (BCC pour basal cell carcinoma), et un type de tumeur
du cerveau, le médulloblastome [3]. La famille des protéines Hedgehog (Hh) contrôle la croissance, la survie,
et le sort des cellules et façonne presque tous les aspects du corps des vertébrés. La voie de signalisation Hh
est donc un élément clé durant l’embryogénèse et est très active durant cette période (gène associé Hh
s’exprime) ; a contrario, elle est relativement inactive durant la vie adulte (le gène Hh est inactif). Cependant,
certaines cellules cancéreuses semblent avoir la capacité à réactiver la voie de signalisation Hh dans les
tissues adultes conduisant au développement de tumeurs malignes. Différentes voies de réactivations ont été
identifiées. La première implique la libération par les cellules cancéreuses d’une protéine activant la voie de
signalisation Hh de cellules environnantes qui favorise la croissance tumorale. Le groupe du Dr. de Sauvage a
également trouvé que la mutation de certains gènes au sein même des cellules cancéreuses résulte en
l’activation constante de la voie de signalisation Hh au sein des cellules ce qui conduit à la production d’un
signal qui aide directement la croissance de la tumeur. A partir de ces connaissances, un inhibiteur de voie de

signalisation Hh, a été synthétisé, le Vismodegib (GDC-0449), et testé chez des patients atteints de BCC en
phase avancée dans le cadre de la phase I de tests cliniques. Dans un premier temps, le Vismodegib s’est
montré très efficace dans le traitement des patients ; les tumeurs ont diminués pour presque disparaitre.
Toutefois, après environ un an de traitement, les tumeurs ont de nouveau réapparu et se sont propagées.
Selon le Dr. de Sauvage et son équipe, l’explication se trouve dans la variété des mutations des cellules
cancéreuses (cf. figure 1).
Figure 1 : Description schématique du mécanisme de reprise de croissance d’une tumeur après
traitement avec un inhibiteur de voie de signalisation Hh. La tumeur cancéreuse initiale (à gauche) est
composée de plusieurs cellules cancéreuses pouvant avoir subi différentes mutations ; nous ne
considèrerons ici que deux mutations par soucis de simplification. Le traitement avec un inhibiteur de
voie de signalisation Hh ciblant la mutation "1" va dans un premier temps permettre une réduction de
la tumeur (centre) par une réduction des cellules cancéreuses portant la mutation "1" mais laissant
intactes les cellules cancéreuses portant la mutation "2". Au cours du temps, les cellules cancéreuses
portant la mutation "2" vont se développer et la tumeur grossit à nouveau.
Crédits : MS&T
Cet exposé démontre la complexité des traitements du cancer et la difficulté à transférer le savoir génomique
en stratégies thérapeutiques bénéfiques et viables cliniquement. Cela est d’autant plus vrai que la fonction
d’approximativement 90% des gènes de l’Homme est inconnue ce qui rend difficile de prédire comment un
changement génétique individuel dans un cancer contribue à la pathogénèse de la maladie ou aux possibilités
de traitement.
C’est à ce problème que le groupe du Dr. Thomas Westbrook au Baylor College of Medicine s’est attelé
depuis une décennie développant des technologies génétiques transformatives qui permettent aux
scientifiques de rapidement trouver la fonction d’un gène [4]. Le Dr. Westbrook a été récompensé du prix
O’Donnel de médecine lors de la conférence TAMEST 2015 [5]. Ce prix lui a été attribué pour son utilisation
intelligente des technologies génétiques pour mettre à jour les circuits génétiques conduisant à la malignité
d’une tumeur chez l’Homme et les nouvelles possibilités de thérapies du cancer qui en découlent. L’une de
ses plus récentes recherches a conduit à l’identification de nouveaux gènes qui participent au cancer du sein
triple négatif (TNBC ou Triple-Negative Breast Cancer), une forme agressive et difficile à traiter de cancer. Ce
travail a conduit directement à de nouveaux traitements testé non seulement au Baylor College of Medicine
mais également dans d’autres centres hospitaliers des Etats-Unis.
D’autres approches au traitement du cancer largement déconnecté de la génétique ont été également
discutées durant TAMEST 2015. En particulier, l’intervention du Dr. James Allison de l’Université du Texas -
Centre du Cancer MD Anderson, et membre de l’Académie Nationale des Sciences des Etats-Unis [6-7]. Le
Dr. Allison est crédité de l’une des plus importantes avancées dans l’histoire du cancer ; l’existence de
multiples voies non-redondantes inhibitrices qui limitent la réponse les lymphocytes T, une catégorie de
leucocytes qui sont responsables de l’immunité cellulaire, face au cancer. La connaissance de ces voies
inhibitrices offre de nouvelles possibilités de traitement par la mobilisation du système immunitaire pour
attaquer les tumeurs cancéreuses. Le Dr. Allison a en particulier parlé des récepteurs de protéines CTLA-4 et
PD-1 qui régulent négativement le système immunitaire. Lors d’un récent essai clinique de phase II, une
combinaison d’anti-PD-1 et anti-CTLA-4 dans des mélanomes a entrainé une réponse positive dans environ
50% des patients atteints de mélanomes en phase avancée. Bien que le Dr. Allison reconnaisse que de
nombreuses recherches restent à réaliser pour arriver à un traitement efficace et viable, il reste très confiant
sur le potentiel de cette approche thérapeutique. Pour ces travaux, certains le verraient bien recevoir un prix
Nobel.
Conclusions
De cette conférence, nous retenons quatre concepts :
- la prévention est un élément clé qu’il faut mettre en lien avec les risques génétiques et environnementaux
des personnes ;

- la détection à un stade précoce de la maladie accroit exponentiellement le taux de survie des patients ;
- il n’existe pas une forme de cancer mais de multiples formes de cancer. La conséquence de cette
constatation est qu’il sera difficile de trouver un remède unique au cancer. Les scientifiques présents ne voient
pas une éradication du cancer dans un avenir proche mais ils promettent une amélioration des soins
notamment grâce à la personnalisation du traitement basé en particulier sur l’héritage génétique des patients ;
- De nouvelles voies de recherche plus globales semblent prometteuses.
—
A lire également :
La Conférence annuelle de TAMEST 2015 sous l’égide du Cancer [partie 1/2]
http://www.bulletins-electroniques.com/actualites/77801.htm
Sources :
- [1] Profil du Dr. James Brugarolas - http://profiles.utsouthwestern.edu/profile/80679/james-brugarolas.html
- [2] Profil du Dr. Frederic de Sauvage - http://www.gene.com/scientists/our-scientists/frederic-de-sauvage
- [3] Vidéo YouTube - Genentech : The Hedgehog Signaling Pathway and Cancer
-https://www.youtube.com/watch?v=XVePUTdUdTw
- [4] Profil du Dr. Thomas Westbrook -
https://www.bcm.edu/people/view/b26b8e5c-ffed-11e2-be68-080027880ca6
- [5] Prix O’Donnell pour la médecine, TAMEST 2015 -
https://www.bcm.edu/news/awards-honors-faculty-staff/westbrook-tamest-edith-peter-odonnell-award
- [6] Profil du Dr. James Allison - http://faculty.mdanderson.org/James_Allison/default.asp?SNID=0
- [7] Profil du Dr. James Allison selon l’American Society of Clinical Oncology (ASCO) -
http://www.ascopost.com/issues/september-15,-2014/immunotherapy-research-of-james-p-allison,-phd,-has-le
d-to-a-paradigm-shift-in-the-treatment-of-cancer.aspx
Pour en savoir plus, contacts :
- Le site du NCI sur les liens entre obésité et risque de cancer :
http://www.cancer.gov/cancertopics/factsheet/Risk/obesity
- Le rapport annuel des avancées cliniques des progrès de la lutte contre le cancer de 2015 de la société
américaine d’oncologie clinique : http://jco.ascopubs.org/content/early/2015/01/16/JCO.2014.59.9746.full.pdf
- Le site du NCI sur les liens entre obésité et risque de cancer :
http://www.cancer.gov/cancertopics/factsheet/Risk/obesity
- Le rapport annuel des avancées cliniques des progrès de la lutte contre le cancer de 2015 de la société
américaine d’oncologie clinique : http://jco.ascopubs.org/content/early/2015/01/16/JCO.2014.59.9746.full.pdf
Code brève
ADIT : 77802
Rédacteurs :
- Christian Turquat, Attaché scientifique, [email protected] ;
- Lucile Alexandre, Stagiaire, [email protected] ;
- Suivre le secteur Physique, Chimie, Nanotechnologies sur twitter @Fr_US_Nanotechs. S’abonner à la
newsletter Nanotechs News : http://www.france-science.org/-FR-US-NanoTechs-Newsletter-.html
- Retrouvez toutes nos activités sur http://france-science.org.
1
/
3
100%