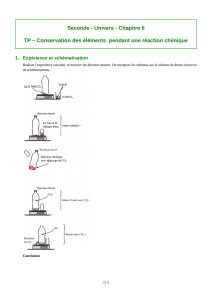
Oxygène et catalyse - Institut des Métaux en Biologie de Grenoble

Oxygène et catalyse
I. Réactivité de l’oxygène
II. Grandes réactions industrielles
utilisant l’oxygène
III. Oxygène et biocatalyse

•Air = 21% de dioxygène.
•Dioxygène nécessaire aux
animaux, plantes et bactéries
aérobes pour la production
d’énergie, métabolisme,
détoxification ...
I. Réactivité de l’oxygène en biologie
Glycolyse en conditions anaérobies:
Glucose + 2ADP + 2Pi ÆLactate + 2ATP + 2H2O
Glycolyse aérobie: O2est l’accepteur final d’électron:
Glucose + 6O2+ 36ADP + 36Pi Æ6CO2+ 36ATP + 6H2O
Remarquez la différence d’efficacité
Energie
Energie

•Air = 21% de dioxygène.
•Dioxygène nécessaire aux
animaux, plantes et bactéries
aérobes pour la production
d’énergie, métabolisme,
détoxification ...
•Paradoxe: Dioxygène est aussi
très toxique à toutes les formes de
vie.
•La vie existe car les organismes
disposent de systèmes de défense
(anti-oxydants) ou de réparation
des dégâts oxydatifs.
I. Réactivité de l’oxygène en biologie
Dommages
Défences

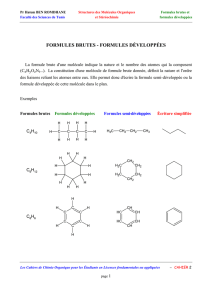
I.1 Diagramme d’OM de O2 et de ses
formes réduites
x
y
z
x
y
z
px, py
pz
OO

O2= diradical
Forme stable de O
Forme stable de O2
2
O
O2
2stable est un
stable est un diradical
diradical
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%