tp 3 : synthese organique ou comment synthetiser et

!"#$%&'&(#)#*(+,-.(#/012)/013#
#
1#
!"#4#5#678!9:6:#;<=>8?@A:#
;A#$;BB:8!#678!9:!?6:<#:!#$;8!<;*:<#*>#"A<:!:#CDA8#B:C?$>B:8!#
!
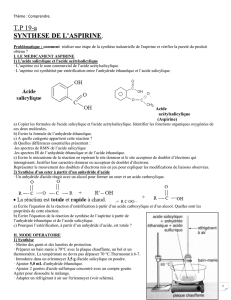
Objectif!:! *(# EFG# H(# I(# !"# (JG#H(# IKLJKM&H(.# M(J# NIOF&J# (PQR.&'(LGNFP# HF# MSIR(#(L#.(HRIKF-.NLG# H(J# 'KLGNT(J# (G# 'RG%KH(J#
(PQR.&'(LGNM(J#G.,J#+.ROF(''(LG#FG&M&JRJ#(L#JSLG%,J(#K.TNL&OF(U!
#
?8!<;CA$!?;8#5#*D>$?C:#6>*?$7*?@A:#:!#*D>6"?<?8:#
#
*DNJQ&.&L(#N#H(J#Q.KQ.&RGRJ#NLNMTRJ&OF(J#VH&'&LFG&KL#H(#MN#HKFM(F.#(G#H(#MN#+&,-.(W#(G#IX(JG#FL#NLG&IKNTFMNLGU#*(#Q.&LI&Q(#NIG&+#OFX&M#
IKLG&(LG#(JG#MXNI&H(#NIRGSMJNM&ISM&OF(#H(#+K.'FM(#5##
#
C,J#MXNLG&OF&GRY#M(J#'RH(I&LJ#T.(IJ#Q.RQN.N&(LG#H(J#HRIKIG&KLJ#Z#ENJ(#H(#MXRIK.I(#H(#JNFM(#VJNM&P#(L#
MNG&LW#QKF.#JKFMNT(.#M(J#HKFM(F.J#(G#M(J#+&,-.(JU#"MFJ#GN.HY#M(J#JI&(LG&+&OF(J#KLG#QF#&JKM(.#MN#JFEJGNLI(#
NIG&-(#H(#I(G#N.E.(#(G#MXKLG#NQQ(MR(#NI&H(#JNM&ISM&OF(#5#
#
*(#Q.KEM,'(#H(#MXNI&H(#JNM&ISM&OF(#(JG#OF(#JKL#NI&H&GR#&..&G(#M(#GFE(#H&T(JG&+U#?M#+NFG#NGG(LH.(#1[\]#QKF.#OF(#^RM&P#9K++'NLLY#_(FL(#
I%&'&JG(#NMM('NLH#G.N-N&MMNLG#QKF.#MN#+&.'(#`NS(.#G.KF-(#FL#'KS(L#H(#JSLG%RG&J(.#H(#MDNI&H(#NIRGSMJNM&ISM&OF(#VOF&Y#GKFG#(L#NSNLG#
M(J#'a'(J#Q.KQ.&RGRJ#OF(#MDNI&H(#JNM&ISM&OF(Y#(JG#E&(L#JFQQK.GR#QN.#MDK.TNL&J'(W#Z#QN.G&.#H(#MDNI&H(#JNM&ISM&OF(U#
>F_KF.HD%F&Y#MXNJQ&.&L(#(JG#M(#'RH&IN'(LG#M(#QMFJ#IKLJK''R#NF#'KLH(#5#43#000#GKLL(J#JKLG#Q.KHF&G(J#I%NOF(#NLLR(Y#JK&G#100#
'&MM&N.HJ# H(# IK'Q.&'RJU# :MM(# (JG# NFJJ&# &LGRT.R(# Z# H(# LK'E.(FJ(J# NFG.(J# Q.RQN.NG&KLJU# :L# ^.NLI(# QN.# (P('QM(Y# QMFJ# H(# /40#
'RH&IN'(LGJ#IK''(.I&NM&JRJ#IKLG&(LL(LG#H(#MXNJQ&.&L(U##
#
"<:*?B?8>?<:6#
#
"KF.#.RNM&J(.#MN#JSLG%,J(#H(#MDNJQ&.&L(Y#KL#'RMNLT(.N#3,5!g!d’acide!salicylique#N-(I#6,0!mL!d’anhydride!éthanoïque#(L#Q.RJ(LI(#
H(#OF(MOF(J#TKFGG(J#d’acide!sulfurique!concentréU#
*DROFNG&KL#E&MNL#H(#I(GG(#.RNIG&KL#(JG#MN#JF&-NLG(#5##
#
!
Question!1!"!#$%&'()(%*!%'!&+,,%*!-%.!/*+01%!23*32'4*(.'(50%.!$%!-632($%!.3-(27-(50%!%'!$%!-632($%!324'7-.3-(27-(50%8!
!
Question! 2!"! 9%! ,423&(.,%! $%! 2%''%! *432'(+&! %.'! $+&&4! 2(:$%..+0.8! #-! .%! $4*+0-%! %&! 2(&5!32'%.! 4-4,%&'3(*%.8! ;-32%*! -%.! )-<2=%.!
.2=4,3'(.3&'!-%!$41-32%,%&'!$%.!$+0>-%'.!?!2=350%!4'31%8!
#
#
#
#
OH
OH
O
+O
OOO
OH
O
O
+OH
O
Acide salicylique Anhydridre
éthanoïque
Acide
acétylsalicylique Acide
éthanoïque
NOM!

!"#$%&'&(#)#*(+,-.(#/012)/013#
#
/#
:GNQ(#1#5#>IG&-NG&KL#H(#MDRM(IG.KQ%&M&(#H(#MDNL%SH.&H(##
#
:GNQ(#/#5#>HH&G&KL#LFIMRKQ%&M(#
#
:GNQ(#4#5#<RNIG&KL#NI&HK)ENJ&OF(#
# #
:GNQ(#2#5#:M&'&LNG&KL#
#
:GNQ(#3#5#<RNIG&KL#NI&HK)ENJ&OF(#5#FL#9b#(JG#M&ER.R#
#
Question!3!"!@0%-!%.'!-%!*A-%!$%!-632($%!.0-)0*(50%!B!C0.'()(%*!-3!*41+&.%!?!-63($%!$60&!3*/0,%&'!1+*'3&'!.0*!-%!,423&(.,%8!!
!
!
!
!
!
Question!4!"!D3-20-%*!-%.!503&'('4.!$%!*432'().!,(.!%&!E%08!@0%-!%.'!-%!*432'()!%&!%F2<.!B!
G&=7$*($%!4'=3&+H50%!"!!
#
#
#
G2($%!.3-(27-(50%!"!!
!
!
!
Question!5!"!D3-20-%*!-3!,3..%!'=4+*(50%!$63.1(*(&%!50%!-6+&!+>'(%&$*3('!$3&.!-6=71+'=<.%!$60&%!*432'(+&!'+'3-%8!
!
!
!
!
!
!
!
!
O
OO
+H+
O
OO
H
O
OO
HOH
OH
O
+
O
OO
H
O
OH
O
H
O
OO
H
O
OH
O
H
O
OO
H
O
OH
O
H
OH
O
O
H
O
OH
O
O
OO
H
O
OH
O
H
+
O
H
O
OH
O
O
O
OH
O
+H+

!"#$%&'&(#)#*(+,-.(#/012)/013#
#
4#
C;88::6#"976?@A:6#:!#6:$A<?!:#
678!9:6:#C:#*D>$?C:#>$:!7*6>*?$7*?@A:#
"KF.#GKFJ#M(J#'KLGNT(J#'N.OFRJ#HDFL(#RGK&M(#*!Y#J(#.R+R.(.#Z#MN#+&I%(#c#!(I%L&OF(J#H(#ENJ(#(L#I%&'&(#K.TNL&OF(#dU#
#
1.!Synthèse!
• CNLJ#FL#ENMMKL#.eHR#H(#/30#'*Y#&LG.KHF&.(#4Y3#T#HDNI&H(#JNM&ISM&OF(U#
• >_KFG(.# fY0# '*# HDNL%SH.&H(# RG%NLKgOF(# Z# MDN&H(# HDFL(# Q&Q(GG(# T.NHFR(# (il! sera!
prélevé!et!introduit!dans!le!ballon!sous!la!hotte!et!avec!des!gants).!
• >_KFG(.#4#KF#2#TKFGG(J#HDNI&H(#JFM+F.&OF(#IKLI(LG.R#N-(I#FL#IK'QG(#TKFGG(U#
• <RNM&J(.#FL#montage!de!chauffage!à!reflux*#(G#M(#+N&.(#-R.&+&(.#QN.#M(#Q.K+(JJ(F.U#
• $%NF++(.#Z#.(+MFP#Q(LHNLG#10#'&LU!La!température!ne!doit!pas!dépasser!les!70°CU##
#
!Questions!du!synthésiste!:!!
• @0%-!%.'!-6(&'4*I'!$0!,+&'3/%!?!*%)-0F!B!
!
!
!
!
• @0%!)30':(-!)3(*%!?!-6(..0%!$%!2%''%!4'31%!B!
!
!
!
!
!
!
!
Acide!salicylique!
Anhydride!éthanoïque!
Acide!acétylsalicylique!
Acide!sulfurique!
d!(densité)!
#
1Y0[/#
#
#
M!(g.molR1)!
14[Y1#
10/Y0#
1[0Y1#
#
Température!de!
fusion!
#
#
143h$#
#
Aspect!
"KFH.(#I.&JGNMM&L(#
&L+MN''NEM(#
*&OF&H(#OF&#JD%SH.KMSJ(#(L#
Q.RJ(LI(#HD(NFU#`&(L#.(+(.'(.#
MN#EKFG(&MM(U#
"KFH.(#I.&JGNMM&L(#EMNLI%(#
HDKH(F.#IN.NIGR.&JG&OF(U#
*&OF&H(#-&JOF(FPY#
&LIKMK.(#(G#&LKHK.(#
Solubilité!
#
#
?LJKMFEM(#HNLJ#MD(NF#Z#+.K&HU#
6(#HRIK'QKJ(#HNLJ#MD(NF#Z#
100h$U#!.,J#JKMFEM(#HNLJ#
MDRG%NLKM#Z#I%NFH#(G#Z#+.K&HU#
#
Sécurité!
"KFH.(#&..&GNLG(#QKF.#M(J#
'FOF(FJ(J#KIFMN&.(J#(G#
.(JQ&.NGK&.(J#QKF-NLG#
Q.K-KOF(.#H(J#MRJ&KLJ#
KIFMN&.(JU#:L#INJ#HD&L%NMNG&KLY#
+N&.(#.(JQ&.(.#H(#MDN&.#+.N&JU#:L#
INJ#H(#IKLGNIG#N-(I#M(J#S(FP#
MN-(.#NEKLHN''(LG#Z#MD(NFY#
QNFQ&,.(J#RIN.GR(JU#:L#INJ#
HD<(JG&KL#+N&.(#EK&.(#
E(NFIKFQ#HD(NF#(G#Q.K-KOF(.#
M(#-K'&JJ('(LGU##
#
<RNT&G#-&-('(LG#N-(I#MD(NF#KF#
(L#Q.RJ(LI(#HD%F'&H&GR#VE&(L#
.(+(.'(.#M(#+MNIKLWU##
iNQ(F.J#&..&GNLG(J#QKF.#M(J#S(FP#
(G#M(#L(jU#:L#INJ#HD&L%NMNG&KLY#
+N&.(#.(JQ&.(.#H(#MDN&.#+.N&JU#:L#
INJ#H(#
IKLGNIG#N-(I#M(J#S(FPY#MN-(.#
NEKLHN''(LG#Z#MD(NFU#:L#INJ#
HD<(JG&KL#+N&.(#EK&.(#
E(NFIKFQ##
HD(NFU##
".KHF&G#&L+MN''NEM(U##
#
#
#

!"#$%&'&(#)#*(+,-.(#/012)/013#
#
2#
!Questions!techniques!:!Le!montage!à!reflux!
• @0%-!%.'!-%!*A-%!$0!.011+*'!4-4J3'%0*!B!
!
!
!
!
• C0.'()(%*!-%!.%&.!$%!2(*20-3'(+&!$%!-6%30!$3&.!-%!*4)*(/4*3&'8!
!
!
!
!
!
!
2.!Séparation!
• <(+.K&H&.#M(#ENMMKL#Z#MDN&.#
• i(.J(.#JKL#IKLG(LF#HNLJ#FL#ERI%(.Y#(G#M(#.(+.K&H&.#HNLJ#FL#EN&L#H(#TMNI(#V'RMNLT(#(NF#b#TMNI(#Q&MR(WU#
• >_KFG(.# Q.KT.(JJ&-('(LGY# QN.# Q(G&G(J# OFNLG&GRJY# ]0# '*# HD(NF# H&JG&MMR(# +.K&H(# VQKF.# H&JQKJ(.# HD(NF# H&JG&MMR(# +.K&H(Y# KL#
JGKIk(.N#FL(#Q&JJ(GG(#HNLJ#FL#EN&L#H(#TMNI(WU#
• >GG(LH.(#MN#I.&JGNMM&JNG&KL#GKGNM(#H(#MDNJQ&.&L(U#
@0%!)3(*%!.(!-63.1(*(&%!&%!2*(.'3--(.%!13.!B!K(!*(%&!&%!.%!13..%L!+&!1%0'!/*3''%*!-4/<*%,%&'!-%.!13*+(.!(&'%*&%.!$0! >3--+&!3J%2!0&%!
>3/0%''%!$%!J%**%8!9+*.!$%!2%''%!+14*3'(+&L!$%.!,(2*+:42-3'.!$%!J%**%!.%!M!$42*+2=%&'!N!%'!.%*J%&'!$%!/%*,%.!?!-3!2*(.'3--(.3'(+&8!
• Essorer!les!cristaux!sur!entonnoir!BüchnerlY#laverl#N-(I#H(FP#+K&J#10'*#HD(NF#+.K&H(U#
• "MNI(.#M(#Q.KHF&G#Z#MDRGF-(#Q(LHNLG#10#'&LFG(JU#
#
Questions!techniques!:!L’essorage!sur!Büchner!
O%..(&%*!-%!$(.1+.('()!$6%..+*3/%!.+0.!J($%!%'!1*42(.%*!.+&!(&'4*I'8!!
!
!
!
!
!
!
!
!
!
!
!
!
!
!Questions!du!synthésiste!:!!
P&%!)+(.!-3!.7&'=<.%!%))%2'04%L!50%!$+(':+&!%&J(.3/%*!%&.0('%!B!!
!
!
!
!
!
!
!
!

!"#$%&'&(#)#*(+,-.(#/012)/013#
#
3#
3.!Evaluation!de!la!pureté!de!l’acide!acétylsalicylique!synthétisé!
!
• Mesurer!la!température!de!fusion!au!banc!Köfler*!5#!+FJ(PQ1m## # #
#
;L#Q.RJ(LG(.N#M(#.RJFMGNG#'FL&#H(#JKL#&LI(.G&GFH(U##
O+&&4%.!"!!
;+0*!0&!3113*%(-!/*3$04L!
slecture =1graduation
12
!
93!'+-4*3&2%!$0!>3&2!Q+)-%*!%.'!4J3-04%!?!RSTD8!
!
!Questions!du!synthésiste!:!#
D+,,%&'%*!-%!*4.0-'3'!$%!-3!,%.0*%8!@0%!)30':(-!)3(*%!,3(&'%&3&'!B!!
!
!
!
!
!
!
!
4.!Purification!du!produit!obtenu!par!recristallisation!
• !.NLJ+R.(.#M(J#I.&JGNFP#HDNJQ&.&L(#HNLJ#FL#(.M(L'(S(.#(G#'KF&MM(.#N-(I#M(#'&L&'F'#HDRG%NLKM#Z#\0h#VM(J#I.&JGNFP#HK&-(LG#aG.(#
_FJG(#.(IKF-(.GJWU#
• <RNM&J(.#FL#montage!de!recristallisationlU##
• $%NF++(.# HKFI('(LG# M(# 'RMNLT(# _FJOFDZ# REFMM&G&KL# (G# .(H&JJKMFG&KL# IK'QM,G(# H(J# I.&JGNFPU# 6&# MN# .(H&JJKMFG&KL# LD(JG# QNJ#
IK'QM,G(Y#N_KFG(.#M(#'&L&'F'#V'NP#4'*W#HDRG%NLKM#QN.#M(#%NFG#HF#.R+.&TR.NLGU#
• >..aG(.#M(#I%NF++NT(U#>_KFG(.#QN.#M(#%NFG#HF#.R+.&TR.NLG#10#'*#HD(NF#H&JG&MMR(#I%NFH(#VQ.&J(#NF#EF.(NFWU#
Remarque!"!2%''%!4'31%!&6%.'!13.!.7.'4,3'(50%!-+*.!$60&%!*%2*(.'3--(.3'(+&8!!
• !.NLJ-NJ(.#M(#IKLG(LF#H(#MD(.M(L'(S(.#HNLJ#FL#ERI%(.#Q.KQ.(U#
• ;EJ(.-(.#MN#I.&JGNMM&JNG&KL#H(#MDNI&H(#NIRGSMJNM&ISM&OF(U#;L#Q(FG#R-(LGF(MM('(LG#QMNI(.#M(#ERI%(.#HNLJ#FL#EN&L#HD(NF#TMNIR(U#
• Essorer!les!cristaux!sur!entonnoir!BüchnerlY#M(J#laverl#N-(I#H(FP#+K&J#10'*#HD(NF##+.K&H(U##
• "MNI(.#M(J#I.&JGNFP#HNLJ#FL(#IKFQ(MM(#GN.R(#(G#NF#Q.RNMNEM(#(G#M(J#'(GG.(#Z#MDRGF-(U#
#
Questions!techniques!:!La!recristallisation!
• UF1-(50%*!-%!1*(&2(1%!$%!-3!*%2*(.'3--(.3'(+&8!
!
!
!
!
!
!
!
!
!
• 96%30! +0! -64'=3&+-!.+&':(-.! $%! >+&.! .+-J3&'.! 1+0*! -3! *%2*(.'3--(.3'(+&! $%! -63.1(*(&%!B! D+,,%&'%*!3-+*.!-%! 2=+(F! $60&!
,4-3&/%!%30:4'=3&+-!1+0*!2%''%!*%2*(.'3--(.3'(+&8!
!
!
!
!
!
!
 6
6
1
/
6
100%