S1 PC - SPI - SPA

Partiel n°2 - 1er semestre 2013/2014
LICENCE PHYSIQUE-CHIMIE
ET SCIENCES POUR L'INGÉNIEUR
S1 PC - SPI - SPA
Lundi 24 novembre 2014
PARTIEL DE CHIMIE n°2
Durée : 1h 30
Les calculatrices sont autorisées
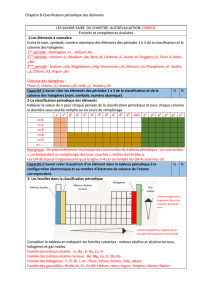
Exercice 1 : Tableau périodique ( 5 points)
1. Donner la configuration électronique des atomes suivants en indiquant
l’occupation de la couche de valence, dont les numéros atomiques sont : 4X, 5X, 12X, 13X,
24X, 31X, 38X.
2.
X(4) : 1s2 2s2
X(5) : 1s2 2s2 2p1
X(12) : 1s2 2s2 2p6 3s2
X(13) : 1s2 2s2 2p6 3s2 3p1
X(24) : 1s2 2s2 2p6 3s2 3p6 4s1 3d5
X(31) : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
X(38) : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
3. Pour chacun, indiquer à quel bloc (s, p, d ou f), il appartient.
Bloc s : X(4), X(12), X(38)
Bloc p : X(5), X(13), X(31)
Bloc d : X(24)
4. Indiquer ceux qui appartiennent à la même famille et ceux qui appartiennent à la
même période (vous donnerez le numéro de la période).
Même famille : X(4), X(12), X(38) et X(5), X(13), X(31)
Même période : n=2 X(4), X(5) ; n=3 X(12), X(13) ; n=4 X(24), X(31)
5. Quel est celui qui est le plus gros ? Justifier à partir de l’évolution du rayon covalent
dans le tableau périodique.
Dans le tableau périodique, le rayon diminue le long d’une période et augmente de haut en
bas dans une famille.
X(38) : couche la plus élevée, n=5.
6. Quel est celui qui a l’énergie d’ionisation la plus forte ? Justifier à partir de
l’évolution de l’énergie de première ionisation dans le tableau périodique. Vous
définirez également le terme énergie d’ionisation.
Energie de première ionisation : énergie qu’il faut fournir pour arracher l’électron le plus
externe à un atome pris dans son état fondamental à l’état gazeux.
X → X+ + e-
Dans le tableau périodique, l’EI augmente le long d’une période et diminue de haut en bas
le long d’une famille.
X(5) : le plus haut et ensuite le plus à droite.

Partiel n°2 - 1er semestre 2013/2014
Exercice 2 : Tableau périodique 2 (2 points)
Retrouver la position de l’élément X dans le tableau périodique sachant que :
Son rayon covalent plus petit que celui du silicium.
Son énergie d’ionisation plus faible que l’oxygène.
Son affinité électronique est relativement forte.
Il peut être hypervalent.
On le trouve à l’état solide dans la nature, mais peut facilement s’associer à des
atomes plus légers pour former des molécules gazeuses : XO2, H2X
Retrouver le nom de cet élément, sa configuration électronique et donc son numéro atomique.
Vous argumenterez votre réponse en utilisant chacune des informations données. Toute
réponse non justifiée ne sera pas comptée.
S, 1s2 2s2 2p6 3s2 3p4, Z=16 : à droite du Si (donc plus petit), en dessous de O (donc EI plus
forte), peut facilement former l’ion S2- donc son affinité électronique est forte, appartient à la
couche n=3 donc peut être hypervalent, SO2 (valence 4) et H2S (valence 2).
Exercice 3 : Schémas de Lewis et géométries ( 8 points) (voir plus loin)
1. Pour chacune des espèces suivantes : CH2Cl2, ONCl, TeCl4, BrF3, I
Cl4
−
1.1 Donner le schéma de Lewis (l'atome central est indiqué en gras).
1.2 En appliquant les règles de la VSEPR (donner le type VSEPR), et après avoir précisé
les figures de répulsion, donner leur géométrie (aucune de ces molécules n’est cyclique).
Faire des schémas clairs en précisant bien les angles de valence (angles de liaisons). Si
nécessaire, vous ferez les commentaires qui s’imposent sur ces angles.
Exercice 4 : Schémas de Lewis et Mésomérie ( 6 points)
1. On vous donne cinq schémas de Lewis incomplets de l'ion arséniate As
O4
3−
(A) (B) (C) (D) (E)
1.1 Vous devez, sans changer la multiplicité des liaisons engagées avec l’atome
d’arsenic, recopier et compléter chaque schéma en y faisant figurer l’ensemble des doublets
non liants et faire apparaître les charges formelles dans chacune des représentations.

Partiel n°2 - 1er semestre 2013/2014
1.2 Quel est l’atome le plus électronégatif entre As et O ? Justifier.
O est en haut et à droite de As dans la classification périodique, il est donc plus électronégatif.
1.3 Classer ces formes mésomères par ordre de représentativité décroissante. Justifier.
(C) et (E) > (D) > (B) > (A) ou bien (C) et (E) > (B) > (D) > (A)
C et E ont le même nombre de charges formelles, portées par les atomes d'O plus
électronégatifs que As
Dans D il y a plus de charges formelles que dans C et E.
Dans B il y a des atomes d'électronégativité différente qui portent les mêmes charges.
Dans A il y a une charge négative élevée portée par l'atome le moins électronégatif.
2. On considère les ions suivants : nitrate N
O3
−
et séleniate Se
O4
2−
(l'atome central est
indiqué en gras) :
2.1 Ecrire les formes mésomères les plus représentatives (de représentativité
identique) pour chacun des ions. Montrer que l’on peut passer de l’une à l’autre des formes
mésomères par les règles de la mésomérie, en déplaçant des doublets.
Se
O4
2−
: 16 DV
2.2 Combien de longueurs de liaison différentes, respectivement NO et SeO, a-t-on
dans chaque ion ? Justifier clairement votre réponse.
Dans chacun de ces ions on a une seule longueur de liaison, intermédiaire entre simple et
double.
Données : extrait de la classification périodique
1H
6C
7N
8O
9F
13Al
15P
17Cl
33As
34Se
35Br
52 Te
53I


1
/
5
100%