Notice 67953949

ANSM - Mis à jour le : 12/12/1997
1. DENOMINATION DU MEDICAMENT
BIOCARDE, solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Aubépine (extrait hydroalcoolique fluide de sommités fleuries et de fruits)
................................................ 40 ml
Passiflore (teinture de parties aériennes)
............................................................................................... 10 ml
Valériane (teinture de racines)
.............................................................................................................. 15 ml
Avoine (extrait hydroalcoolique fluide de parties aériennes fleuries)
......................................................... 10 ml
Mélisse (extrait hydroalcoolique fluide de parties aériennes fleuries)
....................................................... 10 ml
Agripaume (teinture de parties aériennes)
.............................................................................................. 15 ml
Pour 100 ml de solution buvable.
Titre alcoolique: 63 % (V/V).
3. FORME PHARMACEUTIQUE
Solution buvable.
4. DONNEES CLINIQUES
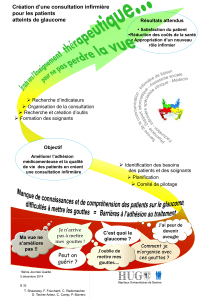
4.1. Indications thérapeutiques
·Traditionnellement utilisé dans les troubles de l'éréthisme cardiaque de l'adulte ayant un
cœur sain.
·Traditionnellement utilisé dans le traitement symptomatique des états neurotoniques de
l'adulte et de l'enfant notamment en cas de troubles mineurs du sommeil.
4.2. Posologie et mode d'administration
Chez l'adulte:
Eréthisme cardiaque: 15 gouttes, 3 fois par jour.
Troubles mineurs du sommeil: 15 gouttes le soir au dîner et 15 gouttes au coucher
Chez l'enfant de plus de 6 ans:

Troubles mineurs du sommeil: 6 gouttes le soir au dîner et 6 gouttes au moment du coucher
4.3. Contre-indications
Hypersensibilité à l'un des constituants.
4.4. Mises en garde spéciales et précautions d'emploi
ATTENTION: LE TITRE ALCOOLIQUE DE CE MEDICAMENT EST DE 63 % (V/V) SOIT 210
mg D'ALCOOL POUR 15 GOUTTES ET 84 mg POUR 6 GOUTTES.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Non renseignée.
4.6. Grossesse et allaitement
Non renseignée.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
4.8. Effets indésirables
Non renseignée.
4.9. Surdosage
Non renseignée.
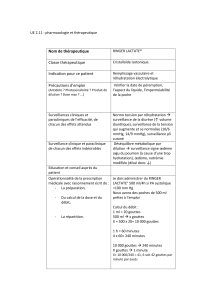
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Phytothérapie et éléments minéraux à visée sédative.
5.2. Propriétés pharmacocinétiques
Non renseignée.
5.3. Données de sécurité préclinique
Non renseignée.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Sans objet.
6.2. Incompatibilités
Sans objet.

6.3. Durée de conservation
2 ans.
6.4. Précautions particulières de conservation
A conserver à une température inférieure à 25°C.
6.5. Nature et contenu de l'emballage extérieur
30 ml en flacon (verre jaune de type III) fermé par un bouchon (polyéthylène haute densité)
muni d'un compte-gouttes (polyéthylène basse densité).
6.6. Précautions particulières d’élimination et de manipulation
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Laboratoires LEHNING
3, rue du Petit Marais
57640 Sainte Barbe
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
·301 165-9: 30 ml en flacon (verre jaune).
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter par le titulaire]
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE
Médicament non soumis à prescription médicale.
1
/
3
100%