Chapitre1 act2 la classification periodique de mendeleiev eleves

Chimie – Partie 1 : Organisation et transformations de la matière – Chapitre 1 : Structure de la
matière
Activité 2 : Histoire de la classification périodique
A. La petite histoire
1) Etat des lieux des connaissances de l’époque
En 1860, on connaît 63 éléments chimiques (environ 115 aujourd'hui)
Les connaissances sur ces éléments sont assez détaillées et comprennent:
- les propriétés physiques: aspects, températures de changement d'état, masses atomiques
(comparées à celle de l'hydrogène, le plus léger des éléments pris pour référence)...
- les propriétés chimiques: réactivité vis-à-vis des autres éléments, formules des corps composés
qu'ils engendrent avec d'autres éléments...
Par contre, la structure intime de la matière telle qu'on la décrit aujourd'hui n'est pas encore connue:
l'idée d'atome n'est pas admise par tous et on est loin de connaître les particules qui le composent !
2) Les idées de Mendeleiev
Mendeleïev, professeur de chimie à l'université de Saint Pétersbourg à partir de 1866, a travaillé à la
rédaction de l'ouvrage : "Principes de la chimie".
Au travers de cet ouvrage, Mendeleïev a étudié de façon systématique les éléments chimiques
connus et a essayé de les "ordonner", comme d'autres avaient déjà essayé de le faire avant lui, sans
parvenir à des résultats aussi rigoureux et élaborés que ceux de Mendeleïev
Ainsi, pour chaque élément, il a rassemblé sur une fiche tous les renseignements connus à l'époque
Sa première idée, toute simple, a été de les ranger par masse atomique croissante (nombre de
masse noté A).
Ce faisant, il est frappé par la régularité de l'évolution des propriétés chimiques et surtout par le fait
qu'à intervalles fixes, des propriétés physiques et chimiques semblables se répètent (ressemblances
physiques, chimiques et corps composés de même formulation)
Ce constat lui amène une deuxième idée: celle d'ordonner les éléments sous forme d'un tableau. La
première version de ce "tableau périodique" sera publiée en 1869.
Vous allez maintenant partir sur les traces de Mendeleïev en reconstituant en partie sa démarche.
Nous allons reprendre le tableau de classification tel qu’il existe aujourd’hui (les 3 premières lignes)
mais en mettant des croix dans les cases correspondants aux éléments non connus à l’époque.
Remarque : le nombre de masse A (ou masse atomique de l’atome correspond en fait au nombre de
nucléons de l’atome, c'est-à-dire son nombre de protons additionné à son nombre de neutrons.
B. Questions
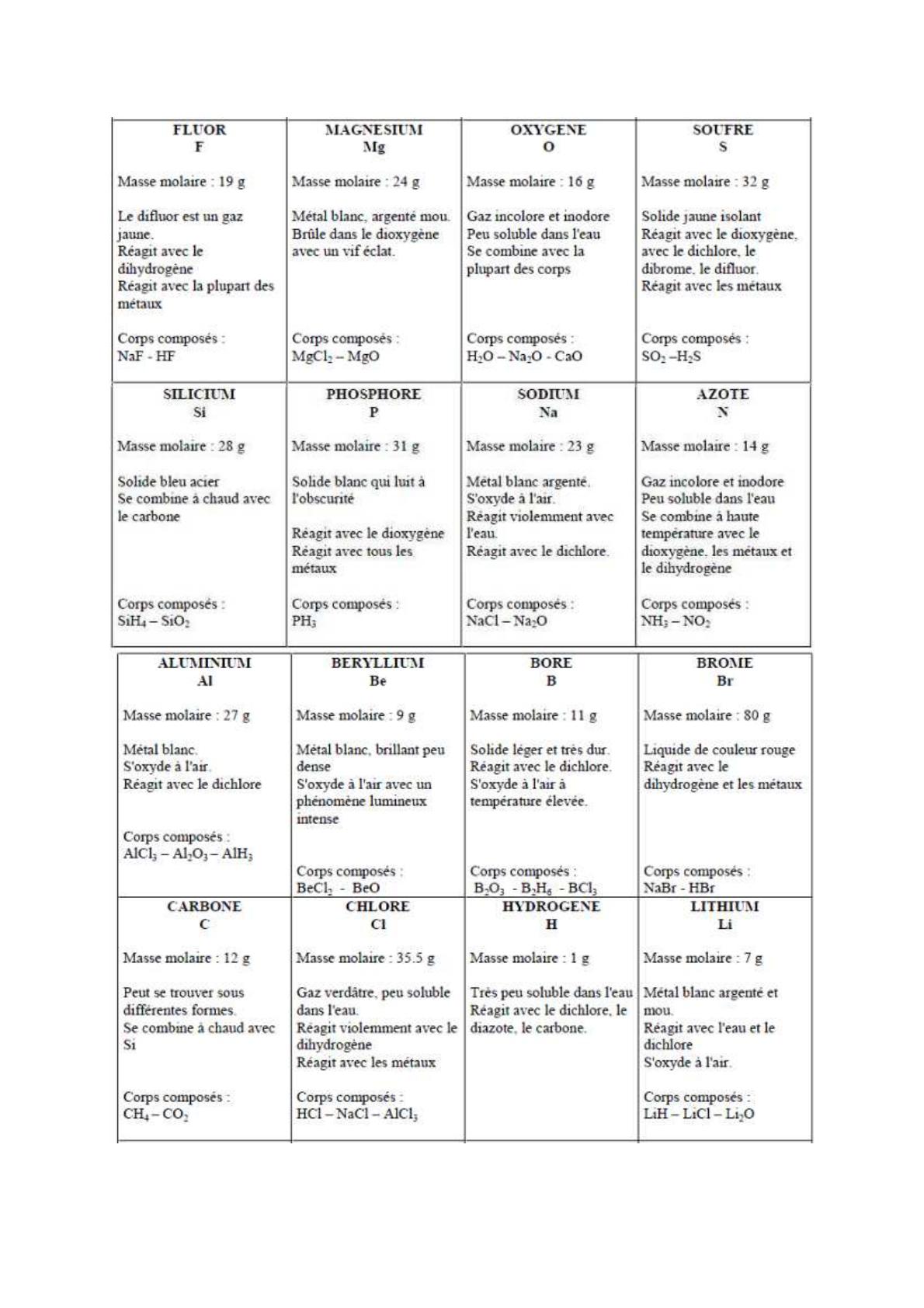
1) Compléter le tableau de classification en suivant la méthode de classification de Mendeleïev
(Aide : tu as à disposition en fin d’activité un jeu de cartes correspondant aux différents éléments à
classer).

Chimie – Partie 1 : Organisation et transformations de la matière – Chapitre 1 : Structure de la
matière
2) Complète ton tableau de classification initial avec les éléments suivants (Recopier le tableau
précédent et compléter les cases manquantes avec les éléments ci-dessous) :
Hélium He : Masse molaire = 4g/mol
Néon Ne : Masse molaire = 20.2g/mol
Argon Ar : Masse molaire = 40g/mol
3) Tu as classé dans l’ordre les différents éléments précédents en suivant la méthode de Mendeleïev.
En fait, la position dans le tableau correspond à ce que l’on appelle en chimie le numéro atomique Z
de l’atome. Il correspond au nombre de protons d’un atome. En déduire le nombre de protons de
chacun des éléments précédents.
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
4) Que peux tu alors dire du nombre d’électrons de chacun d’entre eux.
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
5) Peux tu alors calculer le nombre de neutrons d’un atome connaissant son numéro atomique Z et
son nombre de masse A ? Calculer le nombre de neutrons du silicium, du sodium et de l’azote par
exemple.
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………….
Chimie – Partie 1 : Organisation et transformations de la matière – Chapitre 1 : Structure de la
matière
1
/
3
100%











