Allylboration enantiosélective d`isatines catalysée par des acides

Proposition de stage Master 2 (année 2016-2017)
Allylboration enantiosélective d’isatines catalysée par des acides phosphoriques
chiraux dérivés du BINOL
De nombreux composés chiraux issus du BINOL existent dans la littérature et sont très utilisés soit
comme ligands en catalyse asymétrique organométallique, soit en organocatalyse asymétrique.1 Par
exemple, les acides phosphoriques dérivés du BINOL sont des dérivés bien connus pour leur utilisation
comme catalyseurs bifonctionnels porteurs à la fois d’un site acide de Brønsted, d’une base de Lewis et
des substituants en position 3,3' qui jouent un rôle crucial en fournissant un environnement chiral.
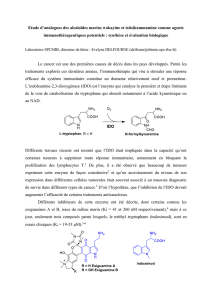
Les acides phosphoriques ont déjà été utilisés avec succès dans la réaction d’allylboration avec les
aldéhydes pour préparer des alcools homoallyliques énantiomériquement enrichis.2 A notre connaissance,
très peu de résultats ont été décrits concernant les cétones.
L’objectif du stage sera donc de tester les catalyseurs déjà synthétisés au laboratoire en allylboration
enantiosélective du motif isatine. Une fois la mise au point effectuée, la méthodologie pourra être validée
sur des substrats ciblés qui peuvent donner accès à des produits naturels, notamment la famille des
convolutamydines.3
Le stage se déroulera dans le cadre de la mise en place de la nouvelle équipe CORINT (Chimie
Organique et INTerfaces).
Contacts :
Claudia Lalli François Carreaux
Campus Villejean - Bâtiment 5 Campus Beaulieu - Bâtiment 10A
2, avenue du Professeur Léon Bernard Avenue du Général Leclerc
References :
1. a) D. Parmar, E. Sugiono, S. Raja, M. Rueping, Chem. Rev. 2014, 114, 9047-9153; b) C. Lalli, P. van de Weghe, Chem.
Commun. 2014, 50, 7495-7498.
2. a) P. Jain, J. C. Antilla, J. Am. Chem.Soc. 2010, 132, 11884-11886. b) T. Miura, Y. Nishida, M. Morimoto, M. Murakami,
J. Am. Chem. Soc. 2013, 135, 11497-11500. c) T. Cadart, P. Koukal, M. Kotora, Eur. J. Org. Chem. 2014, 7556-7560. d) R.
Hemelaere, F. Carreaux, B. Carboni, Eur. J. Org. Chem. 2015, 2470-2481.
3. N. Hara, S. Nakamura, N. Shibata, T. Toru, Chem.-Eur. J. 2009, 15, 6790-6793.
1
/
1
100%