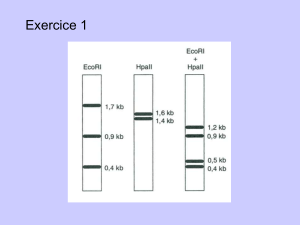
physiologie animal

Année Universitaire : 2007-2008
République Algérienne Démocratique Et Populaire
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE EL-HADJ LAKHDAR
BATNA
FACULTE DES SCIENCES
DEPARTEMENT DE BIOLOGIE
MEMOIRE
Pour l’obtention du diplôme de
MAGISTER
Option : Biologie Cellulaire et Physiologie Animale
Présenté par:
Melle : DEFFA Wafa
THEME
CARACTERISATION DE LA CROISSANCE
FŒTALE IN UTERO PAR ECHOGRAPHIE CHEZ
LA CHATTE
Devant la commission d’examen :
D.NAIMI
M.YAHIA
N. ALOUI
S.AMEDDAH
O.BOUAZIZ
A.AISSI
Prof, Université de Constantine
M.C, Université de Batna
Prof, Université de Batna
M.C, Université de Constantine
M.C, Université de Constantine
M.A, Université de Batna
Présidente
Rapporteur
Examinateur
Examinatrice
Examinateur
Invité

Année Universitaire : 2007-2008
République Algérienne Démocratique Et Populaire
MINISTERE DE L'ENSEIGNEMENT SUPERIEUR
ET DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE EL-HADJ LAKHDAR
BATNA
FACULTE DES SCIENCES
DEPARTEMENT DE BIOLOGIE
MEMOIRE
Pour l’obtention du diplôme de
MAGISTER
Option : Biologie Cellulaire et Physiologie Animale
Présenté par:
Melle : DEFFA Wafa
THEME
CARACTERISATION DE LA CROISSANCE
FŒTALE IN UTERO PAR ECHOGRAPHIE CHEZ
LA CHATTE
Devant la commission d’examen :
D.NAIMI
M.YAHIA
N. ALOUI
S.AMEDDAH
O.BOUAZIZ
A.AISSI
Prof, Université de Constantine
M.C, Université de Batna
Prof, Université de Batna
M.C, Université de Constantine
M.C, Université de Constantine
M.A, Université de Batna
Présidente
Rapporteur
Examinateur
Examinatrice
Examinateur
Invité

Remerciements
Au nom de DIEU, Omnipotent, Omniscient, qui m’a guidé pour réaliser
ce travail.
Je tiens à remercier vivement le docteur : Yahia M; Maître de
conférences à L’Université de Batna et lui témoigne ma profonde
reconnaissance, pour la proposition du thème de mon mémoire et pour la
direction parcimonieuse de mes travaux en dépit des multiples occupations
que lui imposent l’enseignement et la recherche tout particulièrement.
Puis, j’exprime ma profonde gratitude au Docteur Aissi A; pour
l’aide précieuse qu’il m’a apporté.
Par ailleurs, je suis redevable à tous qui m’ont aidé.
Mes Sincères remerciements vont :
au Pr. D. NAÏMI de la faculté des Sciences de la Nature et de la
Vie, Université de Constantine qui nous a fait l’honneur d’accepter la
présidence de notre jury de mémoire,
au Pr. N. Aloui de l’université de Batna,
au Dr. S. Ameddah de l’université de Constantine, maître de
conférences,
au Dr. O. Bouaziz de l’université de Constantine, maître de
conférences, membres du jury de mémoire qui ont accepté de juger ce
modeste travail.

Dédicace
A ma mère,
A mon père,
A Nour elhouda , ma sœur ,
A Taki addine ,
A dhiaa elhak,,
A Chams addine ,mes frères,,
A Seyf el islam
A toute ma famille,
Avec tout e mon affection
Deffa wafa

Table des matières
Liste des figures
Liste des photos
Liste des tableaux
Introduction
Partie Théorique
I. Anatomie de l’appareil génital et physiologie sexuelle de la chatte ............................................................01
I.1.Anatomie de l’appareil génital femelle ...................................................................................01
I.1.1. Ovaires ..............................................................................................................................01
I.1.2. Trompes utérines ..............................................................................................................01
I.1.3. Utérus ...............................................................................................................................01
I.1.4. Vagin ................................................................................................................................01
I.1.5. Sinus uro-génital ...............................................................................................................01
I.2 Echographie de l'appareil génital de la chatte ..........................................................................03
I.3. Physiologie sexuelle de la chatte .............................................................................................03
I.3.1. Cycle œstral ......................................................................................................................03
I.3.1.1. Cycle anovulatoire ....................................................................................................04
- Proestrus ...................................................................................................................04
- Œstrus ......................................................................................................................04
- Postoestrus................................................................................................................05
- Anoestrus .................................................................................................................05
I.3.1.2. Cycle ovulatoire ........................................................................................................06
- Ovulation .................................................................................................................06
- Pseudogestation .......................................................................................................07
- Gestation ..................................................................................................................07
I.4. Equilibre endocrinien du cycle sexuel .....................................................................................09
I.4.1. Cycle œstral ......................................................................................................................10
I.4.1.1. Profil hormonal du cycle ...........................................................................................10
I.4.1.2. Cycle anovulatoire ....................................................................................................10
I.4.1.3. Cycle ovulatoire ........................................................................................................10
I.4.1.4. Pseudogestation .........................................................................................................11
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
1
/
78
100%