Ascaridiose

1
Nématodes à transmission per os
Ascaridiose
I/ Définition:
Parasitose intestinale la plus fréquente dans le monde, l’ascaridiose est causée par un ver rond,
Ascaris lumbricoïdes, qui appartient a l’embranchement des Helminthe, classe des Nématodes et
famille des Ascaridés
II/ Morphologie :
1. Les adultes:
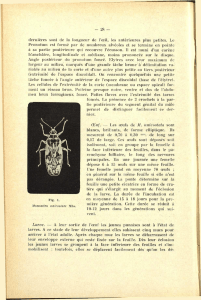
Ascaris lumbricoïdes est un ver rond, de 12 à 30 cm de long sur 2 à 4 mm de diamètre pour le mâle,
de 20 à 35 cm sur 3 à 6 mm pour la femelle.
Les ascaris adultes vivent de 6 à 18 mois dans le jéjunum où ils ingèrent les particules alimentaires.
Ils migrent facilement et peuvent se retrouver dans différents viscères.
2. Les œufs :
Les œufs de forme ovalaire et symétrique de 50 à 80 µm x 35 à 55 µm, à coque externe épaisse et
mamelonnée brun foncé, à coque interne lisse, incolore et très épaisse, lorsqu’ils sont fécondés.
III/ Cycle évolutif :
Les femelles fécondées pondent des œufs, (stade 1 du cycle parasitaire), éliminés dans le milieu
extérieur ou ils s’embryonnent dans des conditions de température élevée (28-32)et de forte
humidité(stade 2 du cycle parasitaire).
Après ingestion, la larve contenue dans les œufs embryonnés est libérée dans le tube digestif
(stade 3 du cycle parasitaire).
Elle traverse la paroi intestinale et gagne le foie soit par la veine porte soit par le mésentère. Elle
séjourne trois à quatre jours dans le foie, y subissant une mue puis gagne par voie sanguine le
Poumon (stades 4 et 5 du cycle parasitaire). La larve traverse alors la paroi de l’alvéole pulmonaire,
remonte l’arbre bronchique jusqu’au pharynx où habituellement elle est déglutie en direction du
tube digestif (stade 6 du cycle parasitaire). La larve gagne le jéjunum où elle devient adulte (stade
7 du cycle parasitaire). Les femelles commencent à pondre environ 2 mois après ingestion de l’œuf
correspondant.

2
IV/ Mode de contamination:
La contamination se fait par ingestion des œufs embyonnés mélangés avec les eaux de boisson, les
légumes, les fruits souillés, la terre en cas de géophagie, voir inhalés mélangés à de la poussière
Cette parasitose cosmopolite est favorisée par la chaleur, l’humidité et les risques de
contamination fécale (utilisation d’engrais humains).
V/ Réservoir du parasite :
L’ascaridiose est une maladie strictement humaine, le sol constitue un excellent réservoir de
parasite, les sujets infestés représentent un autre
VI/La clinique:
Les manifestations cliniques dépendent de l’importance du parasitisme Elles sont habituellement
absentes en cas de pauci-parasitisme.
La phase de migration larvaire est marquée par un syndrome de Löffler : accès de toux
accompagnés de fièvre et d’images radiologiques pulmonaires fugaces asymétriques.
La phase d’état (correspond a la présence des vers adultes dans l’intestin grêle) est fréquemment
marquée par des troubles digestifs (épisodes diarrhéiques, douleurs abdominales mal localisées ;
exceptionnellement des signes nerveux (irritabilité, troubles du sommeil voire convulsions).
Des complications chirurgicales peuvent être observées par migration d’adultes donnant des signes
d’angiocholite fébrile, de pancréatite aiguë hémorragique ou d’appendicite. Une occlusion
intestinale, un étranglement herniaire, une perforation intestinale peuvent également être
observée.

3
VII/ Diagnostic biologique:
1. La phase d’invasion :
Une hyper éosinophilie apparaît une semaine après la contamination. Elle atteint un
maximum au bout de trois semaines puis décroît progressivement. A cette
hyperéosinophilie est souvent associée une hyperleucocytose.
Recherche d’anticorps : plusieurs techniques peuvent être utilisés ( IFI,
immunoéléctriphorèse,…)mais il a y un risque des réactions croisés
2. La phase d’état :
En phase d’état, 2 à 3 mois après la contamination, le diagnostic est parasitologique :
- Examen parasitologique des selles à l’état frais et après concentration (techniques de Ritchie, de
Bailenger, de Kato) : présence d’œufs ovalaires et symétriques de 50 à 80 µm x 35 à 55 µm, à
coque externe épaisse et mamelonnée brun foncé, à coque interne lisse, incolore et très épaisse,
lorsqu’ils sont fécondés.
- Vers adultes rejetés dans des vomissements
-Le diagnostic sérologique n’a que peu d’intérêt.
VIII/ La prophylaxie:
Hygiène personnelle : - Lavage des mains, propreté des aliments.
Lutte contre le péril fécal :
- Installation de latrines, égouts, traitement des eaux usées.
- Interdiction des engrais d’origine humaine pour les sols des cultures maraîchères.

4
Oxyurose
I/ Définition :
Parasitose intestinale causée par un vers rond cosmopolite, Enterobius vermicularis, l’oxyurose est
une affection strictement humaine.
Enterobius vermicularis appartient a l’embranchement des Helminthes, Classe des Nématodes et
famille des Oxyridés
II/ Morphologie
1. Les adultes :
L’oxyure adulte est un ver rond et blanc, de petite taille.
Le male mesure 2-4mm/0.1-0.2mm, son extrémité postérieure, tronquée, est recourbée
ventralement.
La femelle mesure 9-12mm/0.3-0.5mm, possède une extrémité postérieure filiforme.
Dans les 2 sexes, l’extrémité antérieure porte une bouche entourée de 3 lèvres rétractiles assurant
une fixation solide a la muqueuse intestinale et 2 crêtes longitudinales latérales permettant une
identification facile des oxyures sur des coupes anatomo-pathologiques.
2. L’œuf :
Les œufs, incolores et lisses, ont une forme ovalaire asymétrique. Ils mesurent de 50 à 60 μm de
long par 30 à 32 μm de large. Dès la ponte, habituellement sur la marge anale, ces œufs
renferment un embryon mobile et sont infectants.
III/ Le cycle évolutif:
La contamination se fait par ingestion d’œufs
qui éclosent dans l’intestin. Les larves évoluent
dans la lumière intestinale où elles subissent
5 mues en 2 à 4 semaines pour devenir adultes.
Ceux-ci sont présents dans la lumière colique.
Seule la femelle gravide franchit le sphincter anal.
Elle s’accroche par sa bouche à la muqueuse anale
et pond en moyenne 10000 œufs avant de mourir.

5
IV/ Réservoir de parasite:
Le réservoir de parasites est l’homme seul.
V/ Mode de contamination:
La transmission est directe de l’anus à la bouche par les doigts, en particulier chez l’enfant ;
indirecte par les objets et les aliments.
La transmission par inhalation d’œufs embryonnés dans les poussières est possible.
L’oxyurose est une parasitose de la vie en famille, en collectivité, surtout chez les enfants
VI/ La clinique:
En général, le portage d’E.vermicularis est asymptomatique. La clinique est dominée par un prurit
anal, prédominant le soir au coucher. Il peut s’accompagner de lésions péri-anales de grattage. Des
épisodes de diarrhée, de douleurs abdominales, de manifestations nerveuses (cauchemars).sont
classiques.
Plus rarement des oxyures peuvent déclencher une appendicite ou être responsables, chez la
petite fille de vulvite.
VII/ Le diagnostic biologique
Le diagnostic est parasitologique:
- visualisation des vers adultes à la marge de l’anus, dans les selles ou les sous-vêtements :
présence d’oxyures femelles, vers blancs, ronds, de 5 à 12 mm de long
- La recherche des œufs caractéristiques pondus sur la marge anale permet une identification facile
de cette parasitose.
Elle doit être réalisée le matin avant toute toilette locale et toute défécation.
La meilleure technique est le test de Graham ou test à la cellophane adhésive (scotch test) qui
consiste à appliquer contre les plis radiés de l’anus la face collante d’un ruban adhésif transparent.
Celui-ci après avoir été collé sur une lame de microscope peut être transporté facilement vers un
laboratoire et regardé au microscope.
VIII/ La prophylaxie:
Des réinfestations sont très fréquemment observées malgré un traitement bien conduit. Il est donc
nécessaire lorsqu’un cas d’oxyurose est observé dans une collectivité (famille essentiellement)
d’en traiter simultanément tous les membres.
La prévention de l’oxyurose consiste également à garder les ongles courts, porter la nuit un pyjama
et dépoussiérer les lieux d’habitation par aspiration ou par lavage.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%