EXE 12.1

Page 1 / 4
T STI2D
Exercices
Physique
Chimie
Chap 14 : Piles et accumulateurs
TRANSPORT
EXERCICE 1 : Partie II.1 du cours
Soit les couples redox suivant : Fe2+ (aq) / Fe (s) Li+(aq) / Li (s) I2 (s) / I-(aq)
1) Parmi les atomes ci-dessus nommer les réducteurs.
2) Qu’est-ce qu’un réducteur ?
3) Parmi les atomes ci-dessus nommer les oxydants.
4) Qu’est-ce qu’un oxydant ?
5) Ecrire les demi-équations électroniques de chacun des couples en équilibrant les charges.
EXERCICE 2 : Partie II.2 du cours
Ecrire les demi-équations électroniques de chacun des couples ci-dessous en milieu acide
Oxonium / Dihydrogène : H3O+/ H2
Dioxygène / Hydroxyde : O2 / OH-
EXERCICE 3 : Partie II.2 du cours
Ecrire la demi-équation électronique du couple ci-dessous en milieu acide
Dioxygène / eau O2 (g) / H2O(aq) (utiliser pour les piles à combustibles)
EXERCICE 4 : Partie II.2 du cours
En s’aidant de la partie II.2 du cours, écrire la demi-équation électronique du couple ci-dessous en
milieu acide.
Dioxyde de plomb/Ion plomb PbO2(s) / Pb2+(aq) (utiliser pour les batteries)
EXERCICE 5 : Parties II et III du cours
On place une lame de fer Fe(s) dans un bécher contenant une solution de
sulfate de fer contenant des ions CU2+(Aq).. Une réaction
d’oxydoréduction se produit.
1) Ecrire la ½ équation de réduction des ions Cu2+ du couple Cu2+ / Cu
2) Ecrire la ½ équation d’oxydation du fer Fe du couple Fe2+ / Fe.
3) En déduire l’équation de la réaction d’oxydoréduction.
4) Qu’est-ce qu’une réaction d’oxydoréduction ?
Pour équilibrer certaines demi-équations électroniques contenant des atomes oxygène
et d’hydrogène, il est nécessaire d’ajouter à cette ½ équation de l’eau H2O .
Pour équilibrer les atomes d’hydrogène de certaines demi-équations électroniques, il
est nécessaire d’ajouter des protons H+ (en milieu acide) ou bien des ions hydroxyde
HO- (milieu basique)
Cu2+ Cu
Fe2+ Fe
Le plus
oxydant
Le plus
réducteur

Page 2 / 4
T STI2D
Exercices
Physique
Chimie
Chap 14 : Piles et accumulateurs
TRANSPORT
EXERCICE 6 : Parties I, II et III du cours
Document : Pile saline(ou pile Leclanché)
Les piles salines mettent en jeu les couples redox Zn2+ / Zn et
MnO2 (s) / MnO(OH) pour produire des électrons.
D’après le document ci-dessus et de la règle du gamma :
1) Indiquer les réactifs (= espèces chimiques initiales) de contenus dans la pile saline.
- Préciser l’oxydant et le réducteur.
- Préciser qui va céder des électrons.
- Quelle est l’espèce chimique qui va donner des électrons ?
- En déduire la borne négative, la borne positive et le sens du courant I sur le schéma.
2) Indiquer les produits (= espèces chimiques produites) de la réaction d’oxydoréduction
3) Quel élément de la pile va s’oxyder ?
4) Quel élément de la pile va se réduire ?
5) Ecrire la demi équation électronique d’oxydation du couple Zn2+ / Zn .
6) Ecrire la demi équation électronique de réduction du couple et MnO2 / MnO(OH) en milieu acide.
MnO2 + _ _ _ _+ _ _ _ _ = MnO(OH)
7) En déduire l’équation bilan d’oxydoréduction.
MnO2 MnO(OH)
Zn2+ Zn
Le plus
oxydant
Le plus
réducteur
Dioxyde de
manganèse (s)
Manganite (s)
Borne
Borne
MnO2
Zn

Page 3 / 4
T STI2D
Exercices
Physique
Chimie
Chap 14 : Piles et accumulateurs
TRANSPORT
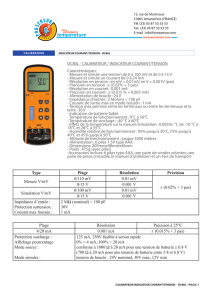
CARACTÉRISTIQUES D’UNE AMPOULE
Type de lampe H1
Voltage [V] : 12
Puissance nominale [W] : 60
EXERCICE 7 : Partie du cours IV.1
Document 1 : Batterie voiture pour Renault Clio II (Diesel) 1.9 D, DTi 09/1998
Document 2 : Caractéristique d’une ampoule pour un phare de voiture
1) Calculer la durée de vie de la batterie si elle fournit en permanence son courant maximal.
2) Un jeune conducteur a oublié d’éteindre les 2 phares de sa voiture toute une nuit. Il retrouve sa
voiture 10h après. Sa batterie POWER START s’est-elle totalement déchargée ?
EXERCICE 8 : Partie IV.2 du cours
Document 1 : Caractéristiques d’une pile au Lithium d’un compteur de vélo
1) Déterminer la quantité d’électrons ne (en mol) ainsi que le nombre d’électrons N pouvant-être produit
par la pile au lithium.
EXERCICE 9 : Partie IV.3 du cours
On s’intéresse à une batterie d’un téléphone portable le Galaxy S4 du
constructeur Samsung.
Sur le recto de la batterie est indiquée sa capacité Q=1,5 A.h ainsi que son
énergie électrique disponible E =5,5 W.h. En déduire la tension nominale
inscrite sur le verso de la batterie.
Marque:NX
Technologie : Plomb ouvert
Tension : 12 V
Capacité minimum : 55 Ah
Dimension de l'unité : 249mm (L) x 175mm (l) x 190mm (h)
Gamme POWER START
Intensité au démarrage : 460 A
PILE AU LITHIUM 2032
Norme IEC: CR2032
3,0 volts
220 mAh
Dimensions (mm): 3 x 20 x 20
Lithium

Page 4 / 4
T STI2D
Exercices
Physique
Chimie
Chap 14 : Piles et accumulateurs
TRANSPORT
EXERCICE 10 : Partie IV.4 et IV.5 du cours
Document 1 : Batterie d’une Clio III
Tension : 12,7 V
Capacité : 55 A.h
Document 2 : Démarreur d’une clio III
Lors du démarrage d’une Clio III, la batterie alimente
un moteur électrique appelé « démarreur ». Ce
moteur électrique permet de lancer le moteur
thermique à combustion interne. Le démarreur
absorbe alors un courant d’intensité 350 A et la
tension U aux bornes de la batterie chute de 12,7 V à
9,2 V.
1) Quelle est la cause de chute de tension aux bornes de la batterie ?
2) Déterminer la chute de tension. En déduire la résistance interne r de la batterie
3) Déterminer la puissance dissipée par effet joule de la résistance r.
4) Déterminer la puissance utilisée par le démarreur.
5) Déterminer le rendement électrochimique de la batterie.
1
/
4
100%