Cancer du col utérin de stade débutant et

Université de Liège Faculté de Médecine
Promoteur : Professeur F. Kridelka
Co-promoteur : Professeur J-M Foidart
Mémoire de thèse présenté en vue de l’obtention du grade de Docteur en Sciences
Biomédicales et Pharmaceutiques
Cancer du col utérin de stade débutant et
dissémination ganglionnaire : analyse informatique
détaillée du réseau vasculaire lymphatique global sur
tissus cervicaux humains
GIGA-Cancer
- Année académique 2013-2014 -
Laboratoire de Biologie des Tumeurs et du Développement
Cédric BALSAT

Remerciements
manuscrit
des personnes qui, de près ou de loin, ont
professionnel et défi personnel.
En premier lieu, je tiens à remercier les Professeurs Agnès Noël, Jean-Michel
Foidart et Didier Cataldo li au sein de leur laboratoire. En particulier
Agnès, je te remercie pour ta disponibilité, ton aide et tes conseils prodigués tout au long de
ces années. Les discussions que nous avons eues autour des résultats, des articles et des
évoluer et ont toujours stimulé chez moi
dans le projet. Monsieur le Professeur Foidart, vous
, que ce
soit par le biais de publications ou de présentations orales. Je vous remercie pour vos
encouragements ainsi que avez accordée depuis le début.
promoteur, le Professeur Frédéric Kridelka, encadré depuis le début. Malgré un
emploi du temps de clinicien chargé, vous avez toujours su vous rendre disponible. Vos
conseils et votre implication tout au long de ce travail mont et me
se. Nous avons parfois dû lutter contre vents et
marrées, mais nous avons toujours accosté à bon port. Merci pour votre soutien, vos
encouragements et votre confiance. Ce fut une expérience enrichissante et un plaisir de
travailler sur ce projet avec vous.
La suite de mes remerciements va au Docteur Silvia Blacher, spécialiste en analyse
au laboratoire. Silvia, ta passion et ton expertise dans ces domaines ainsi,
que ton don pour le développement de nouvelles méthodes de quantification, ont
in
vivre communicative. !
Je remercie également le Docteur Nicolas Signolle dont les talents ont permis de
mettre au point les différentes méthodes de pr
ta gentillesse, ton calme inébranlable, ta bonne humeur et tes "petits programmes". Nous
ié.

Je souhaite aussi remercier tout particulièrement les Docteurs Frédéric Goffin, Aude
Béliard et Carine Munaut
notamment de manière assidue aux réunions "Plan Cancer" internes au laboratoire. Vos
réflexions, analyses et recommandations t
mon travail et tout au long de ces années.
Alexandra Paye, Charlotte
Epicum, Sylvain Hansen, Ludovic Maertens et Benoît Detry pour tous les bons moments
que nous avons partagés, leurs encouragements et leur amitié. Alexandra merci pour ta bonne
humeur et tous tes conseils durant cette thèse. Entre autres, partager nos idées
lors de la rédaction de nos thèses au cours de ces derniers mois. Charlotte, Sylvain et Ludo,
votre bureau ressemble à
tout genre qui
ont vite fait de vous donner le sourire artagée
durant ces années et à Ludo pour ses intarissables "Zedrig" à travers le labo. Finalement, un
tout grand merci à toi Benoît pour les nombreuses discussions sérieuses et moins sérieuses
que nous avons partagées. Excellent collègue ce
fut véritablement un plaisir de passer ces 5 ans en ta compagnie. Encore merci pour ton
amitié !
également indispensable de remercier toutes mes collègues de bureau, les
Docteurs Soraya Labied et Julie Lecomte ainsi que Natacha Leroi et Meggy Suarez-
Carmona. Merci pour la bonne ambiance quotidienne, vos conseils avisés et pour votre
patience. Vous avez malgré vous été victimes de mon humour particulier
des apporté une aide technique.
Notamment Patricia Gavitelli, Isabelle Dasoul et Emilie Feyereisen pour la série
importante de blocs nt techniqués ainsi que pour leurs conseils lors de
la mise au point des marquages immunohistochimiques. Je remercie aussi le Docteur Katty
Delbecque pour son aide et son expertise de pathologiste au cours de ce travail. Je remercie
chaleureusement Karin Vandewalle et Hélène Brisy pour toute leur aide administrative. Un
Laurette
Volders, Marie Dehuy, Guy Roland et Orianne Carnet pour la bonne ambiance partagée
au bench et Morgane Boursy . Merci également au Docteur
Michaël Herfs pour son amitié et ses conseils souvent prodigués à des moments opportuns.

Je tiens à remercier semble des membres du jury pour le temps consacré à
la défense de ma
thèse.
Enfin, je tiens à terminer en remerciant tous mes proches. Merci à ma maman, mes
sœurs, ma grand-mère et Arnaud et encouragé tout au long de
ma thèsetravail t aussi en grande partie grâce à vous. Merci à
Stéphanie, Olivier, Gabriel et mes beaux-parents pour tous leurs conseils et
encouragements. Parmi eux, je remercie tout particulièrement mon beau-père Michel Audrit
pour la relecture de ce manuscrit. Je remercie aussi tous
encouragé et plus particulièrement Simon, Laurie, Raphaël et Stéphanie. Merci à vous les
gars !
La dernière personne que je souhaite remercier, et non la moindre, est ma femme
Anne-Sophie Audrit. Un tout grand merci pour ta patience et ton dévouement durant toutes
ces années et plus particulièrement pendant la rédaction de ce manuscrit. Tu as réussi à gérer
mes moments de
toi !
Avec le soutien du Télévie et du Plan National contre le cancer.

Résumé
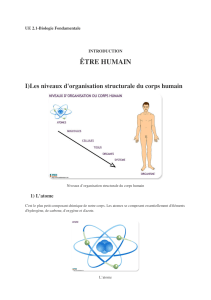
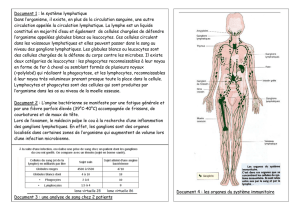
La dissémination lymphatique est un évènement clé lors de la progression des
néoplasies cervicales et des marqueurs tumoraux connexes sont vus comme des facteurs
A ce jour, la lymphangiogenèse (formation
de nouveaux vaisseaux lymphatiques à partir de vaisseaux préexistants) est décrite comme un
locorégionaux et la densité en vaisseaux lymphatiques (LVD) péritumorale est proposée
ire. Cependant, en raison du
-spot, aucun
consensus à ce sujet.
valeur pronostique de la vascularisation
lymnous avons mis au point une technique
robustes, reproductibles et détaillées du réseau vasculaire dans son intég
tumorale a été caractérisée, comparée à celle présente au niveau de cols sains et confrontée
aux paramètres de dissémination ganglionnaire (statut ganglionnaire et emboles
lymphatiques). Nous a lymphangiogène
intense, méconnue à ce jour, sous la zone de transformation des cols sains, région au niveau
de laquelle les néoplasies cervicales se développent. Au cours de la progression tumorale,
nous avons observé que ce microenvironnement spécifique est maintenu. Seule la distribution
des vaisseaux par rapport à la jonction "cellules néoplasiques/stroma" est modifiée. Au niveau
des lésions de stade FIGO un
marqueur de dissémination ganglionnaire, mais que la distribution spatiale des vaisseaux
lymphatiques apparaît comme un élément important lors de la dissémination tumorale.
En conclusion,
vascularisation lymphatique pour une meilleure caractérisation des paramètres pouvant être
impliqués dans le processus de dissémination tumorale. Ils démontrent également que
ation du risque de dissémination lymphatique ne peut se référer exclusivement à une
simple augmentation du nombre de vaisseaux lymphatiques. Ils mettent également en lumière
des modifications de pouvant jouer
un rôle non négligeable dans la progression des tumeurs.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
1
/
152
100%