L`atome – correction - Document sans

1
L’atome – correction
I. Modèle de l’atome : à travers l’histoire :
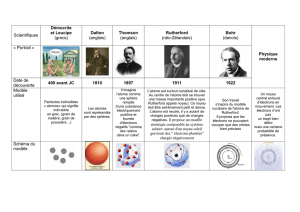
Voici 4 personnages qui ont contribué à connaître l’atome.
430 av JC
1904
1913
1926
Naissance de l’atome
Modèle Plum-pudding
Modèle planétaire
Modèle quantique
3B
2A
1C
4D
Voici 4 phrases qu’ils auraient pu prononcer :
A
Des électrons négatifs se répartissent à l’intérieur d’un noyau positif, de la même façon que les
pruneaux se dispersent dans un cake
B
La matière ne peut être divisée indéfiniment. Elle est faite de grains qu’on appellera atomes, ce qui
signifie qu’on ne peut pas les divisés
C
Les électrons tournent autour du noyau positif comme les planètes de notre système solaire tournent
autour du Soleil.
D
Il faut abandonner le concept de trajectoire de l’électron. Celui-ci est délocalisé dans le nuage
électronique : on parle de probabilité de présence de l’électron au tour du noyau.
Voici 4 documents illustrant les propos ci-dessus :
1
2
3
4
Attribuer à chaque personnage ses propos et l’illustration qui l’accompagne. (Dernière ligne du
premier tableau à compléter).
II. Ce que nous devons retenir :
1. Un exemple : l’atome d’aluminium :
A partir du document ci-contre, décrire l’atome
d’aluminium :

2
2. Le noyau :
Il est formé de nucléons qui sont les protons et les neutrons.
On appelle A le nombre total de nucléons que compte le noyau.
Nucléon
Masse
Charge
Nombre
Proton
mP =1,67.10-27kg
qp = +e = 1,6.10-19C
Z
Neutron
mn ≈ mp
qn = 0 (neutres)
N = A – Z
Vocabulaire :
Z est le « numéro atomique » ou « nombre de charge »
A est le « nombre de masse »
Exprimer N le nombre de neutrons présents dans le noyau en fonction de A et Z (tableau).
3. Les électrons :
Ils n’ont pas de trajectoire précise. Ils se meuvent dans un espace vide, relativement grand par
rapport à la taille du noyau.
Masse
Charge
Nombre
Electron
me =9,1.10-31kg
qe= - e = -1,6.10-19C
Z
4. Neutralité de l’atome :
a. Comparez la charge d’un électron et celle d’un proton :
Les charges sont exactement opposées.
b. Comparez le nombre de protons dans le noyau d’un atome et le nombre d’électrons autour de ce
noyau :
Il y a autant de protons dans le noyau que d’électrons autour de ce noyau.
c. Conclure :
L’atome est électriquement neutre.
5. Masse d’un atome :
a. Comparez la masse de l’électron et celle d’un nucléon :
1835
10.1.9 10.67,1 31
27
e
p
m
m
La masse d’un électron est presque 2000 fois plus petite que la masse d’un nucléon.
b. Pourquoi peut-on affirmer que la masse d’un atome correspond à la masse de son noyau ?
La masse des électrons est négligeable devant celle du noyau.
c. Calculez la masse du noyau de l’atome d’aluminium.
npnoyau mNmZm
kgmnoyau 26272727 10.51,410.67,12710.67,11410.67,113
d. Proposez une formule qui permet de calculer une valeur très approchée de la masse d’un
atome ma en fonction de A et mp :
ppnoyaua mAmNZmm

3
6. Représentation :
On représente un atome en précisant Z et A. Le symbole utilisé est noté X :
Exemples : Décrire chacun des atomes ci-dessous
Nom de l’atome
Nombre de Nucléons
Nombre
d’électrons
Protons
Neutrons
Carbone
6
6
6
Oxygène
8
8
8
Hydrogène
1
0
1
7. Isotopes :
Deux atomes sont isotopes si ils ont le même numéro atomique Z mais un nombre de masse A
différent.
Comparer les noyaux de deux isotopes ?
Les noyaux de 2 isotopes comptent le même nombre de protons mais un nombre de neutrons
différents.
Comme ils ont le même numéro atomique, ils gardent le même nom ; pour les différencier, on ajoute
à leur nom leur nombre de masse A. ex : le carbone 12, le carbone 14, etc.
Représentation
Nbre de
protons
Nbre de
neutrons
Abondance
naturel
H
hydrogène léger
(ou hydrogène -
tout court)
1
0
99,98 %
deutérium
1
1
0,02 %
tritium
1
2
10-4 %
C
carbone 12
6
6
98,2 %
carbone 13
6
7
1,1 %
carbone 14
6
8
10-10 %
III. L’expérience de Rutherford :
En 1909, la structure de l’atome n’était pas connue.
Marsden, Geiger et Rutherford entreprirent d’utiliser
des particules
pour explorer l’atome.
Ils bombardèrent pour cela une feuille d’or d’environ
0,6mm, placée dans une enceinte à vide, par un
faisceau de particules
.
Ils constatèrent que la grande majorité des particules
traversent la feuille d’or sans être déviées. En effet,
la tache observée sur l’écran fluorescent garde la
même intensité avec ou sans feuille d’or interposée.
Seules quelques particules étaient déviées, comme en
témoigne les impacts fluorescents sur l’écran.
Après la fin de l’expérience, la feuille d’or était
intacte.
L’or est un métal. On rappelle qu’un métal est un empilement régulier et compact d’un
même type d’atomes.
X
A
Z
C
12
6
O
16
8
H
1
1
H
1
1
H
2
1
H
3
1
C
12
6
C
13
6
C
14
6

4
Un atome d’or compte 79 protons et 118 neutrons dans son noyau, et 79 électrons
autour de son noyau.
Une particule α (alpha) est un noyau d’atome d’hélium ; il est constitué de 2 protons et
de 2 neutrons.
1. Calculer les masses d’une particule alpha et d’un noyau d’atome d’or.
palpha mm 4
A.N.
kgmalpha 27
10.68,6
palpha mm 11879
A.N.
kgmalpha 25
10.29,3
2. Comparer la masse d’une particule α à celle d’un électron tournant autour du noyau de l’atome
d’or. Qu’arrive-t-il à la particule α lorsqu’elle rencontre un électron ?
7340
10.1,9 10.68,6 31
27
electron
alpha
m
m
Une particule alpha a une masse presque 8000 fois plus importante qu’un électron.
Lorsqu’une particule alpha rencontre un électron, elle l’éjecte de l’atome.
La particule α n’est pas déviée de sa trajectoire.
3. Comparer la masse d’un noyau d’atome d’or à la masse d’une particule α ? Qu’arrive-t-il lorsqu’une
particule α arrive sur un noyau d’atome d’or ?
49
10.68,6 10.29,3 27
25
alpha
or
m
m
Le noyau de l’atome d’or a une masse presque 50 fois plus importante que la particule α.
Une particule alpha rebondit lorsqu’elle rencontre un noyau d’atome d’or.
4. Combien faut-il de couches d’atomes, empilées les unes sur les autres, pour obtenir une feuille d’or
de 0,6mm d’épaisseur sachant que e rayon d’un atome d’or est de 0,15 nm.
6
9
310.2
10.15,02 10.6,0
2
r
e
N
Il y a 2 millions de couches.
5. D’après les réponses que vous venez de donner, quel résultat aurait pu attendre Rutherford
lorsqu’il réalisa son expérience ?
Il s’attendait à ce que les particules alpha soient renvoyées.
6. Proposer une hypothèse qui pourrait expliquer les résultats de l’expérience de Rutherford.
Les noyaux des atomes sont extrêmement petits.
7. Aujourd’hui, on sait que le rayon d’un atome d’or est de 0,15 nm et celui d’un noyau d’or est de 7
fm. Ces informations permettent-elles de confirmer votre hypothèse ?
Comparons un atome à son noyau :
21428
10.7 10.15,0 15
9
noyau
atome
r
r
Le noyau est plus de 20000 fois plus petit que l’atome. Ceci confirme l’hypothèse.
8. Choisir parmi les analogies suivantes, celle qui pour vous traduit le mieux l’expérience de
Rutherford :
b) un enfant qui jette du sable à travers un grillage à larges mailles.
9. En quel sens peut-on dire que le remplissage de l’espace par la matière est lacunaire ?
La matière est concentrée dans les noyaux des atomes qui sont très petits. Les noyaux sont séparés
par des espaces vides (lacunes) qui sont comparativement très grand par rapport aux noyaux.
1
/
4
100%