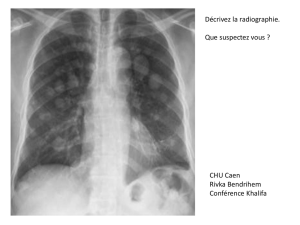
FREQUENCES DES LESIONS PULMONAIRES

Républiquealgériennedémocratiqueetpopulaire
Ministèredel’enseignementsupérieuretderecherchescientifique
UNIVERSITEEL‐HADJ‐LAKHDAR‐BATNA
FACULTEDESSCIENCES
DEPARTEMENTVETERINAIRE
THESE
Présentéeenvuedel’obtentiondudiplômede
DOCTORATENSCIENCESVETERINAIRES
Option:pathologiedesruminants
Par
Mr:MabroukBELKHIRI
Sujet:
FREQUENCES DES LESIONS PULMONAIRES
CHEZ LES RUMINANTS DANS LA REGION DE TIARET
Soutenuele:24/10/2010Devantlejurycomposéde:
Président:MOHAMEDMELIZI,Professeur,universitédeBatna
Rapporteur:MADJIDTLIDJANE,Professeur,universitédeBatna
Examinateur:ABDELLATIFNIAR,Professeur,universitédeTiaret
Examinateur:EL‐HACENBRERHI,Maitredeconférences,universitédeConstantine
Examinateur:LEILAAOUN,Maitredeconférences,universitéd’El‐Tarf
Examinateur:YACINEA.TEBANI,Maitredeconférences,universitédeBatna
Annéeuniversitaire:2009/2010

REMERCIEMENT
Ce modeste travail n’aurait jamais vu le jour sans la collaboration de plusieurs personnes
qui nous ont permis de les côtoyer et auxquelles nous tenons à manifester notre sincère et
profonde gratitude.
Je tiens à remercier mon promoteur Professeur TLIDJANE Madjid, qui m’a guidé pour
la réalisation de ce travail.
Mes remerciements à Mme Benhathat Yamina pour ses efforts et ses déplacements aux
laboratoires de Tlemcen et Sidi-Bellabes pour la réalisation des coupes histopathologiques.
Il est très agréable de remercier tous ceux qui ont contribué de prés ou de loin à
l’élaboration de ce présent mémoire, et de remercier spécialement Professeur MEZIANE Toufik
qui a contribué à mener à bien et à sa fin ce travail, sans oublier les conseils et l’effort moral qui
ont été donnés par les professeurs Niar A. (Université de Tiaret) et Guitarni D. (Université de
Blida) et Mamache B., Boukaaboub K. et Ayache R. de l’Université de Batna.
Mes remerciements aux Mrs : Alloui N., Mehanaoui S., Nouicer F., Safsaf B., Bensbaa
F., Adili N., Laabassi F., Ayachi A., Bennoune H. et à tous les enseignants du département
vétérinaire.
Mes remerciements au président Prof. Melizi M. et à tous les membres de jury Mrs :
Tébani Y.A., Niar A., Bererhi H. et Aoun L. d’avoir accepté de juger et d’examiner ce travail.
Mr. Belkhiri Mabrouk

S O M M A I R E
Partie BIBLIOGRAPHIQUE
CHAPITRE I/ Anatomie, histologie et physiologie de l'appareil respiratoire
I- ANATOMIE
1.1- voies respiratoires supérieures :
a) Deux cavités nasales ou fosses nasales
b) Nasopharynx ou rhino-pharynx
c) Le laryngopharynx
d) Tarchée et ses bifurcations
1.2- Les voies respiratoires inférieures
1.3- Les poumons
1.3- Particularités anatomiques :
1.3.1- Particularités anatomiques du bovin
1.3.2- Particularités anatomiques de l'ovin
II- HISTOLOGIE
2.1- Epithélium des voies respiratoires supérieures
2.2- Structure alvéolaire
III- PHYSIOLOGIE
3.1- Physiologie de la respiration
3.2- Particularités de la fonction pulmonaire
3.3- Fonction non respiratoires du poumon
CHAPITRE II / Classification des différentes pathologies respiratoires
I- LES PERTURBATIONS CIRCULATOIRES DU POUMON
1- Congestion et œdème pulmonaire
2- Les hémorragies pulmonaires
II - LES LESIONS PULMONAIRES
1- L'emphysème pulmonaire (pousse)
2- Atélectasies pulmonaires
III- LES LESIONS INFLAMMATOIRES (OU PNEUMONIES) :
A- LES PNEUMONIES BACTERIENNES :
1.1- La pneumonie pasteurellique
1.2- La pleuropneumonie bovine contagieuse (péripneumonie contagieuse ) :
1.3- La tuberculose pulmonaire

1.4- Les abcès pulmonaires
B- LES PNEUMONIES VIRALES
2.1- Pneumonie à virus du veau
2.2- Pneumonie enzootique du veau
2.3- Infection par le virus respiratoire syncytial bovin
C- PARASITOSES PULMONAIRES
3.1- L'échinococcose
3.2- Dictyocaulose bovine (ou Strongle respiratoire ou Bronchite vermineuse)
3.3- Verminoses ovines
3.4- Distomatose pulmonaire
D- L’ASPERGILOSE
CHAPITRE III/ Mécanismes de défense pulmonaire
1- Les caractéristiques physiologiques
2- Les systèmes physiques de défense
3- Les réflexes automatiques de défense
4- Les systèmes cellulaires de défense
1) Les macrophages
2) Les neutrophiles
3) Les éosinophiles
4) Les lymphocytes
c- Les lymphocytes libres
d- Les nodules lymphoïdes interstitiels
5) Les mastocytes
5- Les systèmes sécrétoires de défense
6- Le surfactant
CHAPITRE IV : Les facteurs de risques
B/ Rappels sur les pneumonies des ruminants
I- Données épidémiologiques et impacts économiques
1-1- Age d'infection et mode de transmission
1-2- Mortalité et morbidité
II) Influence des facteurs environnants
1- L’habitat

a) L’origine des microorganismes et l'animal hôte
b) Normes
c) Ventilation et humidité relative
d) Les conditions climatiques
2- Le colostrum
3- Le mode d'alimentation
4- Agression (stress)
III) Microorganismes responsables
3-1- Les virus
3-2- Les mycoplasmes
3-3- Les bactéries
Partie Pratique
CHAPITRE / MATERIELS ET METHODES
CHAPITRE / RESULTATS
I- Résultats de l’inspection des carcasses
I.1- Fréquence des lésions pulmonaires
I.1.1- Fréquence des lésions pulmonaires selon l’espèce
I.1.1.1- Chez les ovins
I.1.1.2- Chez les bovins
I.1.2- Fréquence des lésions pulmonaires selon l’âge
I.1.2.1- Chez les ovins
a- Jeunes
b- Adultes
I.1.2.2- Chez les bovins
a- Jeunes
b- Adultes
I.1.3- Fréquence des lésions pulmonaires selon le sexe
I.1.3.1- Chez les ovins
a- Mâles
b- Femelles
I.1.3.2- Chez les bovins
a- Mâles
b- Femelles
I.1.4- Fréquence des lésions pulmonaires selon la saison
I.1.4.1- Chez les ovins
I.1.4.2- Chez les bovins
I.2- La répartition des lésions pulmonaires
I.2.1- La répartition des lésions pulmonaires selon l’espèce
I.2.1.1- Chez les ovins
I.2.1.2- Chez les bovins
I.2.2- La répartition des lésions pulmonaires selon l’âge
I.2.2.1- Chez les ovins
a- Jeunes
b- Adultes
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
1
/
160
100%