L`école d`été, organisée par le département Alimentation Humaine

L’école d’été, organisée par le département Alimentation
Humaine, a réuni pour la quatrième année consécutive
une trentaine de doctorants, post-doctorants et jeunes
chercheurs, à Vichy, du 10 au 13 juillet 2006. Les participants
ont pu se retrouver, en nombre volontairement limité dans
l’optique de favoriser les échanges et le partage des connais-
sances, dans une ambiance siple et détendue entre jeunes
chercheurs et chercheurs expérimentés.
Pour cette édition 2006, le thème « Tube digestif : interface avec
l’environnement » était à l’honneur. L’école s’est focalisée sur
certains aspects de cette interface, notamment sur ses fonctions
immunitaires et son contrôle neuro-hormonal.
De ces 3 journées riches en échanges, ressort aujourd’hui
ce document synthétique, fruit de la qualité des synthèses
réalisées par les intervenants et de l’intérêt des discussions
suscitées par les questions posées. Il est donc apparu souhai-
table à l’équipe organisatrice d’en faire bénécier un large
public. Cette synthèse intéressera non seulement les participants
de cette année et des années à venir, mais également et plus
largement tous les chercheurs s’intéressant, de près ou de loin,
à des questions de nutrition.
Je tiens à remercier Jeannine Goacolou, ingénieur de recher-
che, Claire Gaudout, chargée de communication, qui ont rédigé
les synthèses et Fabienne Ducluzeau, maquettiste, pour leur
contribution à l’élaboration de ce recueil.
Bonne lecture à tous,
Cordialement
Patrick Etiévant
Chef du département Alimentation humaine
AlimH2006 3 28/06/07 8:29:48

Comment se déroule l’école d’été ?
L’école d’été réunit doctorants, post-doctorants et jeunes chercheurs, dans un
lieu convivial, pendant 6 demi-journées, autour d’une thématique qui va leur
permettre d’approfondir leurs connaissances, dans un domaine plus ou moins
proche de leur sujet de thèse ou de leur activité quotidienne.
Le principe veut que, tour à tour, au cours de ces journées, les participants
soient dans la position d’enseigné et d’enseignant. Chaque thématique,
déclinant le thème choisi, s’articule autour d’une demi-journée de travail.
Tout d’abord, le chercheur senior sollicité par le département présente
une synthèse de l’état de l’art. Puis, cinq articles scientiques sélectionnés
par celui-ci sont présentés de façon critique par les doctorants sous forme
de présentations orales de 10 minutes.
L’article, choisi et préparé au préalable par l’étudiant, donne ensuite lieu à un
débat animé par le chercheur, qui peut aider l’étudiant dans sa présentation,
si nécessaire.
L’objectif est donc au moins triple :
• développer l’esprit critique et de la discussion contradictoire des jeunes vis-à-vis
et autour des travaux publiés dans la littérature, qu’ils considèrent souvent comme
paroles d’évangile ;
• permettre aux jeunes de passer plusieurs journées consécutives avec
des chercheurs renommés dans les domaines traités et leur offrir des perspectives
de contacts futurs ;
• offrir un cadre convivial, qui favorise des connections fortes entre des étu-
diants et jeunes chercheurs qui n’auraient jamais eu l’occasion de se rencontrer,
ainsi qu’un climat relationnel de chercheur à chercheur avec les organisateurs
et les intervenants.
Zoom sur les écoles d’été précédentes :
Du 15 au 17 juillet 2003
Radicaux libres, stress oxydant, anti-oxydants
Du 15 au 18 juillet 2004
Système nerveux, fonctions cognitives et comportement alimentaire
Du 14 au 17 juillet 2005
Croissance et vieillissement
Cette édition a fait l’objet d’un document de synthèse des différentes inter-
ventions.
AlimH2006 4 28/06/07 8:29:48

Sommaire
L’épithélium intestinal : anatomie, dynamique, fonctions
Session animée par François Blachier ............................................... p 5 - 18
La barrière immunologique intestinale
Session animée par Martine Heyman ............................................... p 19 - 36
La ore intestinale, ses fonctions et sa relation avec le système immunitaire intestinal
Session animée par Marie-Christiane Moreau................................... p 37 - 50
Les hormones gastro-intestinales
Session animée par Theo Peeters...................................................... p 51 - 61
L’axe cerveau-intestin
Session animée par Bruno Bonaz..................................................... p 62 - 76
Les pathologies digestives dites «fonctionnelles»
Session animée par Lionel Bueno..................................................... p 77 - 87
AlimH2006 5 28/06/07 8:29:48

AlimH2006 6 28/06/07 8:29:48

-5-
L’épithélium intestinal :
anatomie,
dynamique, fonctions
François Blachier
Introduction
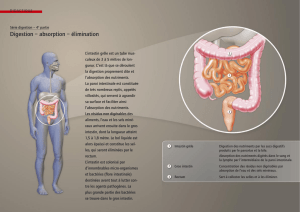
L’intestin grêle commence par le duodé-
num, partie la plus courte de l’intestin.
Viennent ensuite le jéjunum puis l’iléon.
Ce dernier débouche par la valvule iléo-
caecale dans le gros intestin. Celui-ci est
formé du caecum et du côlon, lui-même
subdivisé en côlon ascendant, côlon trans-
verse, côlon descendant et côlon sigmoïde.
Enn, le tube digestif se termine par le
rectum et l’anus.
L’intestin grêle
L’épithélium de l’intestin grêle est consti-
tué de plusieurs « couches ». De l’intérieur
(côté lumière) vers l’extérieur, on trouve la
muqueuse, la sous-muqueuse, des mus-
cles circulaires, des muscles longitudinaux
et la séreuse. Le tube digestif est irrigué
par un réseau important de petites artères
et de veines : les artères apportent l’oxygène
et les nutriments aux cellules de l’intestin ;
les veines charrient les nutriments qui ont
été digérés et absorbés. Elles convergent
toutes vers la veine porte qui va jusqu’au
foie.
La muqueuse épithéliale
Grâce à ses nombreux repliements, la mu-
queuse présente une surface d’absorption
très importante (intermédiaire entre la sur-
face d’un terrain de tennis et celle d’un
terrain de foot). A fort grossissement, on
voit que l’épithélium est constitué d’une
seule couche de cellules et qu’il présente
une structure caractéristique en villosités.
Il repose sur la lamina propria. A la base des
villosités, les cellules sont indifférenciées.
Ces cellules, dites pluripotentes, n’ont pas
encore de fonction physiologique. Elles
donnent naissance à des cellules lles qui
migrent le long de la villosité tout en se dif-
férenciant. Arrivées au sommet de la villo-
sité, elles sont mâtures et sont alors expul-
sées vers la lumière par un processus appelé
anoïkis ou apoptose induite par le déta-
chement. C’est la coordination très étroite
entre les mitoses de la crypte et l’élimi-
nation des cellules mâtures dans la lumière
qui permet de maintenir un nombre cons-
tant de cellules tout au long de l’épithélium.
La cellule épithéliale
Elle présente vers l’extérieur une bordure
en brosse qui augmente encore la surface
d’absorption. Des jonctions serrées, for-
mées par des protéines spécialisées (comme
des occludines ou des claudines) jouent un
rôle de barrière. A l’intérieur de la cellule,
les mitochondries sont très nombreuses ;
elles produisent l’énergie dont la cellule
a besoin, notamment pour les processus
de biosynthèse et pour ses fonctions physio-
logiques. Sous la membrane basale de
la cellule, on trouve la lamina propria,
assise de soutien, richement vascularisée,
qui comporte un certain nombre de cellu-
les, dont des cellules immunitaires.
Cellules différenciées et fonctions
de l’épithélium
La plupart des cellules de l’épithélium
de l’intestin grêle sont des entérocytes.
Ce sont des cellules absorbantes qui réali-
sent la digestion terminale et l’absorption,
AlimH2006 5 28/06/07 8:29:48
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
1
/
73
100%