Thrombolyse de sauvetage en préhospitalier - AP-HM

Thrombolyse de sauvetage en préhospitalier
Des études antérieures ont montré que l'embolie pulmonaire (EP) représente 6% à 11% des
arrêts cardiaques extrahospitaliers [1][2]. Le premier cas de thrombolyse réussie dans l'EP
lors d'une réanimation cardio-pulmonaire (RCP) a été décrit en 1989 [3]. Cependant,
l'utilisation de la thrombolyse préhospitalière pour l'EP est actuellement une thérapeutique de
dernier recours.
L'utilisation préhospitalière de l'échographie s'est généralisée au cours de la dernière
décennie. Notre service mobile d'urgence et de réanimation (SMUR) est maintenant équipé
de dispositifs à ultrasons portatifs pour effectuer des examens échographiques en
préhospitalier. L' "Echo Life Support "(ELS) est un nouveau concept, c'est l'échographie au
chevet du patient utilisé dans le cadre de l'arrêt cardiaque (AC) ou dans les patients en état
critique au pronostic vital engagé à très court terme, où l'analyse peut être effectuée lors d'un
contrôle du rythme cardiaque sans massage et où l'on recherche une cause réversible d'une
activité électrique sans pouls (ou dissociation électromécanique) ou d'une asystolie.
L'échographie peut aussi guider la procédure en cas de causes potentiellement réversibles
(péricardiocentèse, exsufflation et drainage, etc.)
Des nouveaux dispositifs mécaniques ont récemment été mis en place. Ceux-ci réalisent des
compressions thoraciques mécaniques automatiques tout au long d'une RCP prolongée
conformément aux recommandations. Leur efficacité dans les arrêts cardiaques
extrahospitaliers a été démontrée [4].
Cas clinique
Notre service d'aide médical d'urgence (SAMU) a reçu un appel pour une femme de 80 ans
qui a présenté un malaise avec perte de connaissance. Un SMUR est envoyé sur les lieux. À
l'arrivée de l'équipe médicale, la patiente était consciente mais agitée et confuse, avec un
Glasgow estimé à 14, une tension artérielle (TA) de 80/50 mm Hg, une fréquence cardiaque
de 90 battements par minute, une fréquence respiratoire de 35 cycles par minute, et une
saturation pulsée en oxygène de 90% à l'air ambiant et de 96% avec un masque haute
concentration.
L'examen physique ne révèle rien de particulier, en dehors de la perte des urines et des
matières fécales durant sa syncope initiale. Le seul traitement de la patiente est un béta-
bloquant pour hypertension artérielle. Une échocardiographie a été réalisée avec un
échographe ultra-portable (VScan, General Electric Healthcare), montrant uniquement une
dilatation majeure des cavités droites (Fig. 1). Lors de la mise en condition, la patiente s'est
soudainement effondrée avec une dissociation électromécanique comme rythme initial.
La RCP est débutée immédiatement avec une RCP manuelle, une intubation endotrachéale
et de l'adrénaline par voie intraveineuse 1 mg toutes les 3 minutes. Une EP est fortement
suspectée en raison des résultats de l'échocardiographie. Le médecin a donc décidé de
procéder à une thrombolyse et à organiser le recours à un dispositif automatique de
compressions thoraciques. La patiente a reçu 10 mg d'alteplase en bolus intraveineux suivi
d’une perfusion continue d'alteplase 45 mg/h pendant 2 heures.
Après 65 minutes de RCP, on observe une reprise d'activité cardiaque spontanée avec un
rythme sinusal. La patiente était stable, avec une TA 110/70 mm Hg sans amine, une
fréquence cardiaque à 90 battements par minute, une saturation en oxygène pulsé de 98%
sous ventilation mécanique avec une fréquence respiratoire réglée à 10 et une FiO2 à 100%.
La capnographie retrouve un dioxyde de carbone en fin d'expiration à 30 mmHg.

Devant l'absence de réveil immédiat, la patiente est sédatée avec du midazolam et du
fentanyl puis transférée directement en réanimation. A son admission, le scanner thoracique
a confirmé l'EP bilatérale. La patiente n'a pas bénéficié d’hypothermie thérapeutique. La
patiente a repris conscience le jour après l'admission et a été extubée le jour même. La
patiente est finalement sortie de l’hôpital 4 semaines après son AC avec un très bon état
neurologique (Glasgow Outcome Scale à 5).
Discussion
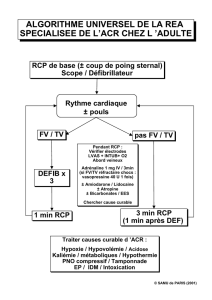
Dans l'AC, tout ce qui est possible doit être fait pour sauver le patient et surtout rechercher
les causes réversibles (4H: Hypoxie, Hypovolémie, Hypo / hyperkaliémie ou trouble
métabolique, l'Hypothermie, et 4T: Thrombose coronarienne ou pulmonaire; Tamponnade
cardiaque, Toxiques, pneumothorax compressif) pour lesquelles un traitement spécifique
existe [5][6].
La généralisation de l'échographie au chevet du patient ou "point of care ultrasound", devrait
permettre de réaliser des diagnostics plus précis en préhospitalier et de renforcer des
suspicions diagnostiques, et donc d'initier plus souvent des thérapeutiques de derniers
recours, en rééquilibrant la balance bénéfices risques. Le concept d'ELS devrait permettre
de plus souvent détecter les AC dus à des EP, car souvent la clinique seule est insuffisante
pour évoquer ce diagnostic et la prise en charge thérapeutique est lourde et coûteuse.
L’échocardiographie au lit du malade, dès la phase préhospitalière permet donc d'initier une
thrombolyse de sauvetage plus fréquemment, en même temps qu’une RCP prolongée.
L'intervalle de temps entre l'AC et le retour à une activité cardiaque spontanée doit être le
plus court possible pour permettre une bonne récupération neurologique, mais la
thrombolyse nécessite un temps de RCP prolongé pour permettre à l’agent thrombolytique
d'agir [7].
Néanmoins, dans notre cas, la bonne évolution neurologique était tributaire de plusieurs
facteurs: témoignage de l'AC par l'équipe médicale et RCP immédiate, utilisation de la
thrombolyse préhospitalière, et l’utilisation d'un dispositif de compression thoraciques
automatisés pendant une RCP prolongée, (i.e. sans diminution de l'efficacité des
compressions thoraciques tout au long de la RCP).
La thrombolyse peut agir par 2 mécanismes différents au cours RCP. Tout d'abord, une
longue procédure de la RCP peut conduire à la fragmentation mécanique du thrombus, avec
par la suite une action thérapeutique plus efficace des agents thrombolytiques [7].
Deuxièmement, les données expérimentales indiquent que la thrombolyse avant, pendant et
immédiatement après la RCP peut améliorer la reperfusion de la microcirculation après AC
[8]. Ceci est très important pour la reperfusion cérébrale et peut contribuer à la bonne
récupération neurologique. Des données récentes soulignent l'innocuité de la thrombolyse
dans l'AC, avec des complications hémorragiques rares [8].
Il y a aussi 2 mécanismes d'action différents des compressions thoraciques mécaniques
automatisés pendant la RCP. Tout d'abord, des compressions thoraciques de haute qualité
réalisée sur une longue période, permettant une perfusion des organes efficace, en
particulier la perfusion cérébrale.
Enfin, une étude a montré des signes morphologiques tomographique de fragmentation
mécanique directe du thrombus conduisant à une plus grande surface des points de contact
sur le thrombus pour l'agent thrombolytique, conduisant finalement à favoriser son action [9].
Néanmoins, malgré ses avantages évidents, des études sont encore nécessaires pour

évaluer la sécurité des compressions thoraciques mécaniques automatisées combinées
avec la thrombolyse dans l'EP.
Auteur :
Hichem CHENAITIA
Services d’urgence et d'imagerie
Centre Hospitalier Géneral de Clavary, BP 53149, Grasse
Courriel : chenaitiahichem@gmail.com
Références :
[1] Kuisma M, Alaspaa A. Cardiac arrests of non-cardiac origin: epidemiology and outcome.
Eur Heart J 1997;18:1122-8.
[2] Courtneya DM, Klineb JA. Prospective use of a clinical decision rule to identify pulmonary
embolism as likely cause of outpatient cardiac arrest. Resuscitation 2005; 65:57-64.
[3] Langdon RW, Swicegood WR, Schwartz DA. Thrombolytic therapy of massive pulmonary
embolism during prolonged cardiac arrest using recombinant tissue-type plasminogen
activator. Ann Emerg Med 1989;18:678-80.
[4] Steen S, Sjoberg T, Olsson P, Young M. Treatment of out-of-hospital cardiac arrest with
LUCAS, a new device for automatic mechanical compression and active decompression
resuscitation. Resuscitation 2005;67:25-30.
[5] Nolan J, Soar J, Lockey A, et al. Advanced life support provider manual. 5th ed. London:
Resuscitation Council (UK); 2006.
[6] Querellou E, Leyral J, Brun C, Lévy D, Bessereau J, Meyran D, et al. In and out-of-
hospital cardiac arrest and echography: a review. Ann Fr Anesth Reanim 2009; 28(9):769-
78.
[7] Bottiger BW, Bohrer H, Bach A, Motsch J, Martin E. Bolus injection of thrombolytic agents
during cardiopulmonary resuscitation for massive pulmonary embolism. Resuscitation
1994;28:45-54.
[8] Bottiger BW. Thrombolysis during cardiopulmonary resuscitation. Fibrinolysis Proteolysis
1997;11(2):93-100.
[9] Bonnemeier H, Olivecrona G, Simonis G, Götberg M, Weitz G, Iblher P, et al. Automated
continuous chest compression for in-hospital cardiopulmonary resuscitation of patients with
pulseless electrical activity: a report of five cases. Int J Cardiol 2009; 136:39-50.
1
/
4
100%