Lire l`article complet

Morphogenèse vertébrale
et malformations
Vertebral morphogenesis and malformations
V. Vincent*, S. Vincent*, O. Pourquié*
* Institut de génétique et de biologie
moléculaire et cellulaire (IGBMC),
CNRS UMR 7104, Inserm U964,
université de Strasbourg, Illkirch.
L
es vertèbres, les côtes, les muscles squelet-
tiques et le derme dorsal proviennent tous
d’une seule et même structure embryonnaire
appelée “somité”. Les somites sont des structures
épithéliales dérivées du mésoderme présomitique
(PSM). Les somites et le PSM forment le mésoderme
paraxial. Les somites sont formés rythmiquement
par paires, par segmentation du PSM à son extrémité
antérieure. Les paires de somites sont produites de
façon symétrique de part et d’autre du tube neural
et de la notochorde, et sont ajoutées successive-
ment dans le sens antéropostérieur. Le mésoderme
constitue le feuillet embryonnaire qui va donner
les tissus internes de l’embryon, les muscles et l’os,
notamment. Il est internalisé pendant la gastrulation,
phase durant laquelle est établi le plan d’organisation
de l’embryon. Pendant l’embryogenèse, l’embryon
s’organise tout d’abord de manière symétrique, selon
un axe antéropostérieur (tête-queue) et dorsoventral.
Par la suite, certains viscères comme le cœur ou le
foie se développent de manière latéralisée. Cette
asymétrie droite/gauche n’est mise en place qu’après
la gastrulation, c’est-à-dire bien après que l’axe anté-
ropostérieur et l’axe dorsoventral sont établis. Cer-
tains organes sont asymétriques, tels, par exemple,
le cœur et l’estomac, qui sont situés à gauche, ou
les poumons, qui ont 3 lobes à droite et 2 à gauche
chez l’homme, tandis que d’autres tissus, comme
le cerveau, se développent de façon symétrique. La
colonne vertébrale, avec les vertèbres, les côtes et
les muscles du squelette, illustre parfaitement ce
caractère métamérique et symétrique le long de l’axe
antéropostérieur. Dans cette revue, nous nous inté-
resserons aux mécanismes génétiques de la somito-
genèse, à la formation des vertèbres et des côtes, des
muscles axiaux et des disques intervertébraux. Nous
parlerons également des conséquences qu’implique
un développement pathologique de ces tissus.
Des somites aux vertèbres
➤
Chez l’embryon humain, la formation des
somites débute vers le 25e jour du développement,
peu de temps après la gastrulation. Le PSM cor-
respond à la région dans laquelle se trouvent les
cellules progénitrices des futurs somites et donc
des muscles, du squelette axial et du derme dorsal,
qui sont encore à un stade indifférencié. Le PSM est
régulièrement balayé par une vague d’expression
de gènes cycliques à chaque formation de somite.
Ces vagues rythmiques de transcription identifient
un oscillateur moléculaire appelé “horloge de seg-
mentation”. Cet oscillateur contrôle le rythme de
production des somites à partir du PSM. Les prin-
cipaux gènes cycliques appartiennent aux voies de
signalisation intercellulaires Notch, FGF (Fibroblast
Growth Factor) et Wnt (de Wingless et integration).
Des études génomiques ont permis d’identifier l’es-
sentiel des gènes cycliques chez la souris, mais le
mécanisme contrôlant leur transcription périodique
n’est pas encore identifié à ce jour (1, 2).
➤
Durant leur maturation, les somites se subdi-
visent tout d’abord en 2 domaines : le sclérotome et
le dermomyotome. Le sclérotome est la structure
qui est à l’origine du squelette axial, c’est-à-dire les
vertèbres et les côtes. Une partie du sclérotome est
à l’origine du syndétome d’où sont issus les tendons.
Le dermomyotome contribue à la formation du
myotome et de tous les muscles du squelette du
tronc et des membres. Il contribue aussi à la for-
mation du derme dorsal et du tissu adipeux brun.
➤
Différents gènes et protéines interviennent dans
le contrôle de la différenciation des somites en élé-
ments qui constituent l’ossature, la musculature et
les cartilages de la colonne vertébrale. La notochorde
et le plancher ventral du tube neural expriment le
facteur Sonic hedgehog (Shh), qui induit la différen-
18 | La Lettre du Rhumatologue • No 381 - avril 2012
MISE AU POINT
LR381-NN-2001_V2.indd 18 17/04/12 09:17

»
La morphogenèse vertébrale est un processus complexe : la formation des vertèbres est contrôlée par un
oscillateur moléculaire appelé ”horloge de segmentation”, agissant lors du développement embryonnaire.
Le dérèglement de cet oscillateur chez l’homme conduit à des scolioses congénitales.
»La scoliose idiopathique pourrait résulter de défauts du système contrôlant l’asymétrie droite/gauche
chez l’embryon.
»
La mutation de certains gènes associés au processus de segmentation conduit à des malformations vertébrales.
»
Chez l’homme, on retrouve des malformations vertébrales liées à des défauts de segmentation comme
le syndrome de Jarcho-Levin, le syndrome de Klippel-Feil, le syndrome d’Alagille ou le syndrome polymal-
formatif de VACTERL.
Mots-clés
Somites
Horloge
de segmentation
Scoliose
Colonne vertébrale
Vertèbre
Highlights
»
The morphogenesis of the
spine is a complex process:
vertebrae formation is under
the control of a molecular
oscillator, called segmentation
clock, acting during embryonic
development. Dysfunction of
this oscillator leads to congen-
ital scoliosis in human.
»
Idiopathic scoliosis could
be the result of defects in the
system establishing left/right
asymmetry in the embryo.
»
Mutation of some genes
involved in the segmentation
process leads to vertebrae
malformations.
»
In human, vertebrae malfor-
mations associated with
segmentation defects are found
in syndromes such as Jarcho-
Levin syndrome, Klippel-Feil
syndrome, Alagille syndrome
or VACTERL syndrome.
Keywords
Somites
Molecular clock
Vertebrate segmentation
Spine
Vertebra
ciation des cellules somitiques en sclérotome. Par la
suite, ces cellules du sclérotome induisent 2 facteurs
de transcription, Paired box 1 et 9 (PAX1, PAX9). Les
cellules du quadrant ventromédial des somites sous
l’influence de ces facteurs de transcription perdent
alors leur structure épithéliale et deviennent du
mésenchyme. Ces cellules se différencient ensuite
en cellules cartilagineuses puis en cellules osseuses.
Les gènes de la voie de signalisation Wnt exprimée
dans la partie dorsale du tube neural et la partie
dorsolatérale du mésoderme paraxial induisent
l’expression de 2 autres facteurs de transcription,
Paired box 3 et 7 (PAX3 et PAX7). Ces 2 facteurs de
transcription contribuent à la formation de cellules
musculaires au niveau du dermomyotome et du
myotome (3). La Bone Morphogenetic Protein 4
(BMP4), protéine exprimée dans la lame latérale du
mésoderme, inhibe la différenciation du myotome
et inhibe Shh (4) [figure 1, p. 20].
➤
Lors de leur formation, les somites acquièrent une
identité régionale selon l’axe antéropostérieur qui est
ensuite traduite en types anatomiques de vertèbres
différentes (cervicale, thoracique, lombaire, sacrée).
Ce mécanisme est contrôlé par la famille de gènes
Homeobox, Hox (5). Au niveau thoracique unique-
ment, les somites fournissent les vertèbres ainsi que
les côtes. Au niveau sacral, les vertèbres fusionnent
pour former le sacrum (6). Le nombre total de somites
formés, tout comme le rythme de production des
paires de somites, est caractéristique de l’espèce.
L’embryon humain a 44 paires de somites, la souris
65, le poulet 52, le poisson zèbre 30, et ce nombre
peut atteindre 500 chez certaines espèces de ser-
pents. Ainsi, on peut voir se former les somites de
façon cyclique toutes les 30 minutes chez le poisson
zèbre, toutes les 90 minutes chez le poulet, toutes
les 120 minutes chez la souris et environ toutes les
8 heures chez l’homme (figure 2, p. 21) [7].
Horloge de segmentation
et scoliose congénitale
➤
La périodicité de la production des somites a
conduit à postuler l’existence d’un oscillateur agis-
sant dans les cellules du PSM. En 1976, Cooke et
Zeeman ont proposé un modèle appelé “the clock
and wavefront model” pour rendre compte du méca-
nisme de segmentation chez les vertébrés (8). Ce
modèle proposait l’existence d’une horloge contrô-
lant la formation rythmique des somites dans le
PSM. La première preuve expérimentale de l’exis-
tence de cette horloge, appelée “horloge de la seg-
mentation” découle de l’observation de l’expression
cyclique du gène c-Hairy 1 dans les cellules du PSM
de l’embryon du poulet (9). Des gènes cycliques ont
été identifiés chez le poisson, les oiseaux et les mam-
mifères, suggérant que l’horloge de segmentation
est conservée chez les vertébrés, y compris chez
l’homme (figure 3, p. 22) [10].
Avant leur individualisation morphologique à l’extré-
mité antérieure du PSM sous forme de somites, les
futurs segments embryonnaires sont tout d’abord
définis au niveau moléculaire sous forme d’une
bande de cellules exprimant certains gènes dits
“de segmentation”. Cette bande se forme dans la
partie antérieure du PSM et définit génétiquement
les futures frontières du somite. Le niveau où se
forme cette bande est appelé “front de détermi-
nation”. Sa position est définie par 2 gradients de
concentration parallèles présentant leur maximum
dans la partie la plus postérieure de l’embryon : un
gradient de signalisation de la voie FGF ainsi qu’un
gradient de signalisation de la voie Wnt (11, 12). Les
facteurs sécrétés FGF 4 et FGF 8 sont distribués en
gradients et maintiennent les cellules du PSM à un
stade indifférencié (13). Le front de détermination
correspond à un seuil de concentration des ligands
FGF et Wnt dans le PSM. Passé ce seuil, les cellules
du PSM deviennent compétentes pour répondre
au signal périodique de l’horloge de segmentation.
À chaque nouvelle oscillation, les cellules qui ont
passé le niveau du front de détermination au cours
du cycle précédent répondent de manière synchrone
au signal de l’horloge en activant les gènes de seg-
mentation. Ce mécanisme conduit à l’expression
de facteurs de transcription comme le gène Mesp2
dans le PSM antérieur, dans 2 groupes de cellules
localisés de part et d’autre du tube neural et situés
juste après le front de détermination. Au sein de
ces bandes s’établira la polarité antéropostérieure
des somites caractérisée par l’expression des gènes
marqueurs de cette polarité, Mesp2 et Ephrin B2, au
futur compartiment postérieur, et des gènes Uncx4.1,
La Lettre du Rhumatologue • No 381 - avril 2012 | 19
Points forts
LR381-NN-2001_V2.indd 19 17/04/12 09:17

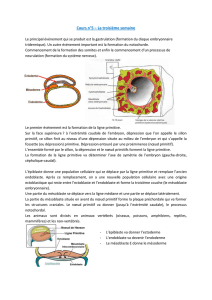
Figure 1. Le mésoderme paraxial ou la
différenciation des somites.
Les somites sont produits dans le méso-
derme paraxial à partir de la région
postérieure du mésoderme présomi-
tique de l’embryon. Différents stades
de différenciation des somites sont
réprésentés sur des schémas de coupe
transversale d’un embryon de souris (1 à
5, positions indiquées sur l’embryon en
haut à gauche). Dans la partie la plus
postérieure, les somites sont des struc-
tures épithéliales (1) situées de part et
d’autre du tube neural et de la noto-
chorde. La partie ventrale du tube neural
et la notochorde (en jaune) produisent
le facteur sécrété Shh (flèches jaunes),
qui induit la différenciation du scléro-
tome dans le quadrant ventromédial
du somite (2) : les cellules du scléro-
tome perdent leur structure épithéliale
et deviennent mésenchymateuses
(en bleu). La partie épithéliale résiduelle
du somite (en mauve) correspond au
dermomyotome. Shh (flèches jaunes)
ainsi que différents facteurs sécrétés
Wnt (flèches vertes) provenant de la
partie dorsale du tube neural et de
l’ectoderme dorsal (en vert) induisent
la délamination des cellules de la lèvre
épaxiale (médiale-dorsale, en rose) et
la formation du myotome (en rose), qui
s’intercale entre le dermomyotome et le
sclérotome (3). La formation de muscle
à partir de la lèvre hypaxiale (ventrola-
térale) est initialement inhibée par la
production de BMP4 (trait rouge) par
le mésoderme de la lame latérale. Dans
les somites plus antérieurs (4), la lèvre
hypaxiale (en rose) ainsi que les lèvres
rostrale et caudale (non représentées)
contribuent à la formation du myotome,
puis (5) la partie centrale du dermomyo-
tome perd sa structure épithéliale et
contribue au derme dorsal (cellules
vertes) et à la réserve de progéniteurs
des cellules musculaires nécessaires à
la continuité du développement muscu-
laire (cellules violettes).
Toit neural
Ectoderme
Dermomyotome
Myotome
Sclérotome
Wnt
BMP
Shh
Somite
Plancher
neural
Notochorde
Tbx18 et EphA4 au futur compartiment antérieur.
Cette polarité antéropostérieure des somites est
fondamentale, car la future vertèbre se formera à
la suite de la fusion de la partie postérieure d’un
somite avec la partie antérieure du somite consé-
cutif, au cours d’un phénomène décrit par R. Remak
au XIXe siècle et appelé “resegmentation” (Remak R.
Untersuchungen über die Entwickelung der Wirbel-
thiere. G. Reimer, Berlin, 1855). La subdivision du
somite est aussi fondamentale pour la segmenta-
tion du système nerveux périphérique, car seule la
partie antérieure du somite autorise la migration des
cellules ou des axones du système nerveux.
Mutations de gènes et malformations
➤
Les scolioses congénitales représentent 1 à 2 cas
pour 10 000 naissances. Elles sont associées à des
déformations vertébrales ou costales, visibles à
l’examen radiologique, ainsi qu’à des malformations
d’autres organes dans de nombreux cas. Elles sont
souvent liées à des complications pulmonaires, du
fait des malformations de la cage thoracique. Leur
traitement implique une prise en charge orthopé-
dique quasi systématique. Plusieurs mutations que
l’on trouve dans la pathologie de plusieurs types
de scolioses congénitales ont été identifiées chez
20 | La Lettre du Rhumatologue • No 381 - avril 2012
Morphogenèse vertébrale et malformations
mise au point
LR381-NN-2001_V2.indd 20 17/04/12 09:17

l’homme et sont toutes associées à des gènes impli-
qués dans l’horloge de segmentation (14).
➤
Les dysostoses spondylocostales ou spondylo-
thoraciques, comme le syndrome de Jarcho-Levin,
présentent en général des hémivertèbres, une fusion
des vertèbres et des côtes, un thorax court, une sco-
liose et une petite taille. Des mutations de 4 gènes
de la voie Notch liés à l’horloge de segmentation
− les gènes Mesp2, Delta-Like 3 (DLL3), Lunatic
Fringe (LFNG) et Hairy and Enhancer of Split 7 (HES7)
[15] − ont été associés à ces pathologies.
➤
Pour le syndrome d’Alagille, la mutation de
2 gènes de la voie Notch ont été identifiés, Jagged 1
(JAG1) et Notch 2 (14). Ce syndrome regroupe des
vertèbres en aile de papillon, une cholestase chro-
nique liée à une paucité des voies biliaires intrahé-
patiques, une sténose de l’artère pulmonaire, ainsi
que des problèmes oculaires et rénaux associés.
Inactivation des voies FGF et Wnt
Chez la souris, les mutations de gènes des voies
FGF et Wnt conduisent fréquemment à des tronca-
tions de l’axe similaires aux syndromes d’agénésie
caudale observés chez l’homme et dont l’étiologie
moléculaire est encore inconnue (13). Les homolo-
gues humains de ces gènes constituent des candi-
dats intéressants susceptibles d’expliquer de telles
malformations chez l’homme.
Contrôle de la symétrie bilatérale
et scoliose idiopathique
Dans l’embryon de souris, l’asymétrie droite/gauche
qui se manifestera ultérieurement par le développe-
ment asymétrique des organes internes est établie par
les rotations des cils du nœud de la ligne embryon-
naire qui produisent un flux orienté vers la gauche. Ce
flux balaie la surface ventrale du nœud et provoque
l’accumulation de la protéine Nodal qui se répand
dans le mésoderme latéral gauche où elle induit le
développement spécifique de la partie gauche de
l’embryon. Cette asymétrie contrôle le positionne-
ment latéralisé du cœur et de certains viscères.
Plusieurs études ont montré le rôle important de l’acide
rétinoïque au cours du développement embryonnaire
dans le maintien de la coordination et la régulation de
la symétrie bilatérale des somites (16, 17). D’autres
études ont montré que la plupart des gènes Hox sont
contrôlés par l’acide rétinoïque. Ces gènes régulent
l’identité des somites selon l’axe antéropostérieur (5).
Ainsi, il a été montré qu’un dysfonctionnement de
la voie de l’acide rétinoïque entraîne la désynchro-
nisation de l’horloge de segmentation des 2 côtés
de la ligne médiane conduisant à la formation de
somites asymétriques. Le fait que, dans les scolioses
idiopathiques, la courbure de la colonne vertébrale
s’oriente dans la plupart des cas du côté droit au
niveau thoracique, suggère un lien possible avec le
système de contrôle de l’asymétrie droite-gauche
embryonnaire (18, 19). Les scolioses idiopathiques
affectent 1 à 5 % de la population et leurs causes
sont encore à ce jour inconnues. Cette déformation
de la colonne vertébrale peut s’avérer gênante d’un
point de vue esthétique, du fait de l’apparition d’une
bosse ou d’une déformation plus marquée du rachis,
mais elle peut en outre provoquer des gênes fonction-
nelles ou respiratoires. Actuellement, le renforcement
musculaire, le port d’un corset et un suivi régulier
constituent la base du traitement. Dans le cas de
scolioses importantes ou réfractaires, une chirurgie
est proposée au patient.
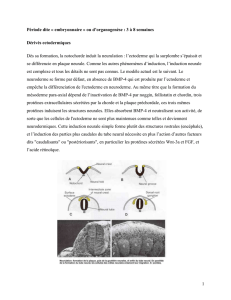
Figure 2. Des somites aux éléments de la colonne vertébrale.
Représentation schématique d’une vue dorsale des somites d’un embryon et d’une colonne
vertébrale d’adulte. La correspondance des domaines embryonnaires et adultes est
indiquée par les lignes discontinues rouges. Chaque vertèbre adulte est le résultat de la
contribution de la partie postérieure du somite en position N (en mauve foncé) et de la
partie antérieure du somite en position N-1 (en mauve pâle). Les muscles de la colonne
vertébrale (en rose) dérivent du myotome des somites. Le décalage entre la position des
vertèbres et des muscles axiaux permet l’articulation de la colonne vertébrale.
Antérieur
Adulte
Embryon
Tube neural
Moelle épinière
Dermomyotome
Myotome
Sclérotome
Disque
Intervertébral
Muscles
axiaux
Vertèbre
Postérieur
La Lettre du Rhumatologue • No 381 - avril 2012 | 21
mise au point
LR381-NN-2001_V2.indd 21 17/04/12 09:17

La recherche clinique
Actuellement, nous ne disposons que de quelques
données sur les causes génétiques de ces malforma-
Figure 3. Horloge de segmentation.
Les somites sont produits de façon cyclique à partir du mésoderme présomitique (PSM).
Sous l’action de l’horloge moléculaire (“clock ”), la partie postérieure du PSM est le siège
de vagues d’expression de gènes cycliques schématisées en vert selon une orientation
rostrocaudale (“wavefront”). La spécifi cation des somites dans la partie antérieure du
PSM se traduit par la stabilisation de l’expression des gènes cycliques et par l’expression
de gènes tels que Mesp2 (en jaune), qui préfi gurent la polarité des futurs somites (Mesp2
marque le futur côté postérieur du somite). Le seuil de spécifi cation des somites, appelé
“front de détermination”, correspond à un niveau d’intersection entre 2 gradients opposés,
l’un postérieur (FGF et Wnt, en bleu) produit par le bourgeon de queue (en orange) et
l’autre antérieur (acide rétinoïque, en rose). Une fois spécifi és au niveau moléculaire, les
somites s’individualisent par épithélisation.
Antérieur
Somites
Domaine d’expression de Mesp2
Domaine de production d’acide rétinoïque
Oscillations de l’expression des gènes cycliques
Progéniteurs
Mésoderme
présomitique
FGF
Wnt
Front de
détermination
Gradients
Acide
rétinoïque
Segments
spécifi és
génétiquement
Postérieur
tions vertébrales. Notre laboratoire propose de cen-
traliser et d’analyser les informations cliniques des
patients qui en sont atteints. Ces données seront
enregistrées dans une base qui sera en relation avec
une autre base rassemblant tous les phénotypes
et les connaissances concernant le processus de
segmentation embryonnaire chez les vertébrés.
Cette approche permettra d’identifi er des gènes
candidats responsables des phénotypes chez les
patients. Cette étude augmentera la compréhension
actuelle des malformations vertébrales et conduira
à une meilleure prise en charge du patient.
Conclusion
La morphogenèse vertébrale est un processus com-
plexe, dont nous commençons à comprendre les
mécanismes moléculaires. Un acteur clé de ce pro-
cessus morphogénétique est l’oscillateur moléculaire,
ou “horloge de segmentation”, qui contrôle la pro-
duction rythmique des précurseurs des vertèbres et
impose la périodicité de la colonne vertébrale. Cet
oscillateur fait intervenir les voies de signalisation
Notch, FGF et Wnt. Si ces cascades moléculaires sont
déréglées ou interrompues, elles provoquent des ano-
malies vertébrales de degré plus ou moins important.
Cependant, ces mécanismes de régulation ne sont pas
encore tous connus. Une meilleure connaissance de la
mise en place des somites, de l’axe antéropostérieur
et de l’asymétrie droite/gauche offrirait la possibilité
de trouver un traitement plus fi n et plus adapté à
chaque patient. Savoir quel gène est responsable de tel
phénotype segmentaire pourrait permettre d’identifi er
précisément la malformation vertébrale ou de prédire
l’évolution d’une scoliose. Mieux connaître les gènes
responsables de ces malformations pourrait aboutir
à la création d’un outil de diagnostic prénatal pour un
meilleur suivi thérapeutique de ces patients. ■
22 | La Lettre du Rhumatologue • No 381 - avril 2012
Morphogenèse vertébrale et malformations
MISE AU POINT
1. McGrew MJ, Pourquié O. Somitogenesis: segmenting a
vertebrate. Curr Opin Genet Dev 1998;8:487-93.
2. Dequeant MLE, Glynn E, Gaudenz K et al. A complex
oscillating network of signaling genes underlies the mouse
segmentation clock. Science 2006;314:1595-8.
3. Relaix F, Rocancourt D, Mansouri A, Buckingham M.
A Pax3/Pax7-dependent population of skeletal muscle
progenitor cells. Nature 2005;435:948-53.
4. Pourquie OC, Fan M, Coltey M et al. Lateral and axial
signals involved in avian somite patterning: a role for BMP4.
Cell 1996;84(3):461-71.
5. Limura T, Denans N, Pourquié O. Establishment of Hox
vertebral identities in the embryonic spine precursors. Curr
Top Dev Biol 2009;88:201-34.
6. Christ B, Ordahl CP. Early stages of chick somite deve-
lopment. Anat Embryol (Berl) 1995;191:381-96.
7. Gomez C, Ozbudak EM, Wunderlich J, Baumann D, Lewis J,
Pourquié O. Control of segment number in vertebrate
embryos. Nature 2008;454:335-9.
8. Cooke J, Zeeman EC. A clock and wavefront model for
control of the number of repeated structures during animal
morphogenesis. J Theor Biol 1976;58:455-76.
9. Palmeirim I, Henrique D et al. Avian hairy gene expression
identifi es a molecular clock linked to vertebrate segmen-
tation and somitogenesis. Cell 1997;91:639-48.
10. Dequeant ML, Pourquie O. Segmental patter-
ning of the vertebrate embryonic axis. Nat Rev Genet
2008;9(5):370-82.
11. Pourquie O, Dale K, Drubrulle J, Jouve C, Maroro M,
McGrew M. A molecular clock linked to vertebrate segmen-
tation. In : Sanders EJ, Lash JW, Ordahl C, eds. The origin
and fate of somites. Amsterdam : IOS Press, 2001:64-70.
12. Aulehla A, Pourquie O. Signaling gradient during
paraxial mesoderm development. In: Briscoe J,
Lawrence P, Vincent J, eds. Reading and Interpreting
Gradients during Development. Cold Spring Harbor:
Laboratory Press, 2009.
13. Naiche LA, Holder N, Lewandoski M. FGF4 and FGF8
comprise the wavefront activity that controls somitogenesis.
Proc Natl Acad Sci USA 2011;108(10):4018-23.
14. Turnpenny PD, Alman B, Cornier AS et al. Abnormal
vertebral segmentation and the notch signaling pathway
in man. Dev Dyn 2007;236:1456-74.
15. Cornier AS, Staehling-Hampton K et al. Mutations in the
MESP2 Gene Cause Spondylothoracic Dysostosis/Jarcho-
Levin Syndrome. Am J Hum Genet 2008;82:1334-41.
16. Duester G. Retinoic acid synthesis and signaling during
early organogenesis. Cell 2008;134:921-31.
17. Niederreither K, Dolle P. Retinoic acid in development:
towards an integrated view. Nat Rev Genet 2008;9:541-53.
18. Vermot J, Pourquie O. Retinoic acid coordinates somi-
togenesis and left-right patterning in vertebrate embryos.
Nature 2005;435:215-20.
19. Vilhais-Neto GC, Maruhashi M, Smith KT et al. Rere
controls retinoic acid signalling and somite bilateral
symmetry. Nature 2010;463(7283):953-7.
Références bibliographiques
LR381-NN-2001_V2.indd 22 17/04/12 09:17
1
/
5
100%