TD Cytosquelette

UE2
TD Cytosquelette (cours S. Delbecq)
Protéines d’adhérence / Jonctions intercellulaires
(T. Maudelonde)
N. Boulle Année 2012-2013
La plupart des illustrations du TD proviennent
de Molecular Biology of the Cell
Alberts, Johnson, Lewis et al.
(5ème édition)
∅ ≅ 25 nm ∅ ≅ 7 nm ∅ ≅ 10 nm
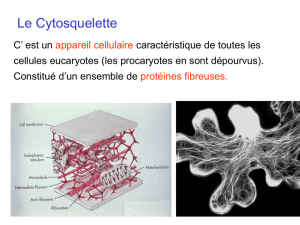
Microfilaments d’actine
MF Microtubules
MT Filaments intermédiaires
FI
25 µm
Définition: Le cytosquelette
∅ ≅ 25 nm
Microtubules

Tubuline et Microtubules
13 protofilaments
α
α
α
α
GTP β
β
β
β
GTP
! Pas de liaisons
covalentes
Les 2 types de Microtubules
•MT labiles:
MT cytosoliques,
Sensibles au froid (0-4°C) et aux agents chimiques (Colchicine, Vinblastine, Taxanes)
Instabilité intrinsèque extrêmement dynamiques
Adaptabilité
•MT stables:
Stabilisés par des protéines spécifiques
Insensibles aux agents physiques ou chimiques : ils ne dépolymérisent jamais
Forment des structures pluritubulaires :
Centriole, corpuscule basal
Axonème
Molecular Biology of the Cell (© Garland Science 2008)
Corpuscule basal
de protozaire
QCM 1
Tubuline et Microtubules
- Tubuline β
- Vers la membrane plasmique
- Tubuline α
- Vers le centre de la cellule
→Vitesse de polymérisation extrémité + > extrémité -
+
-
Séquestre la
tubuline
Les MAP à retenir:
-Protéines stabilisatrices:
MAP2 et Tau (cellules nerveuses)
-Protéines déstabilisatrices:ex: Catastrophine, katanine
-Protéines motrices:dynéines (vers -) et kinésines (vers +)
-MAP associées aux structures pluritubulaires
Les protéines associées aux microtubules
Microtubule Associated Protéine = MAP:
Katanine
Catastrophine
(+TIP)
+-
QCM 1
Tubuline et Microtubules

Formation des microtubules cytosoliques : in vitro
Croissance in vitro: Equilibre dimères de tubulines / microtubule
Notion de concentration critique (Cc)
QCM 1
Tubuline et Microtubules
A l’extrémité, constantes:
kon (polymérisation) (M-1sec-1)
koff (dépolymérisation) (sec-1)
Le nombre de dimères de tubuline qui s’ajoute à l’extrémité par seconde
dépend de la concentration en tubuline (C):
= kon x C
QCM 1
Tubuline et Microtubules
Polymérisation vs dépolymérisation?
- Dimères de tubuline > concentration critique (Cc)→ polymérisation.
Formation et allongement des microtubules
- Dimères de tubuline < concentration critique (Cc) → Pas de microtubules
A l’équilibre, à l’extrémité, Cc où :V Polymérisation = V Dépolymérisation
kon x Cc = koff →Cc = koff / kon
% dimères de
tubuline dans les
microtubules
équilibre
C dimères de
tubuline diminue
! Idem
microfilaments
d’actine
In vitro
QCM 1
Tubuline et Microtubules
Formation des microtubules cytosoliques :
In vivo, équilibre modifié par:
-Coiffe de GTP Extrémité +
-COMT Extrémité –
-MAP
α
αα
α
GTP β
ββ
β
GDP α
αα
α
GTP β
ββ
β
GTP
Extémité - Extémité +
Dimère 1 Dimère 2
Activité GAP
(GTPase Activating Protein)
Sous unité tubuline β: Activité GTPase
Sous unité α: Activité GAP
QCM 1
Tubuline et Microtubules
α
αα
α
GTP β
ββ
β
GTP
Dimères pré-assemblés:
tubuline en solution
Liaison forte
Liaison faible

α
αα
α
GTP β
ββ
β
GTP α
αα
α
GTP β
ββ
β
GTP α
αα
α
GTP β
ββ
β
GTP α
αα
α
GTP β
ββ
β
GTP
α
α
α
α
GTPβ
β
β
β
GDP
α
α
α
α
GTPβ
β
β
β
GDP
α
α
α
α
GTPβ
β
β
β
GDP
α
α
α
α
GTPβ
β
β
β
GDP
α
αα
α
GTP β
ββ
β
GTP
α
α
α
α
GTPβ
β
β
β
GDP
Protofilament courbe
Faible cohésion entre dimères
QCM 1
Protofilament droit
Forte cohésion entre dimères
Tubuline et Microtubules
QCM 2
Tubuline et Microtubules
Jonctions cellulaires →Actine / Filaments intermédiaires
Actine
(jonctions adhérentes)
Filaments intermédiaires
(desmosomes)
Centrioles
9 triplets de microtubules (A, B, C) dont seul A est complet
Ponts de nexine entre les triplets
Structure protéique "en rayons de roue" relie les microtubules A
~ Corpuscule basal (cils, flagelles)
! Triplets
QCM 2
Tubuline et Microtubules
Centriole: appartient au centrosome
nexine
Transports intracellulaires
- Transport de molécules (actine G,…)
- Transport d'organites (mitochondries,…)
- Transport d'acides nucléiques liés à protéines: ARNm et chromosomes
lors des divisions
- Transport vésiculaire: endocytose, exocytose, R.E., Golgi…
Fonctions des microtubules cytosoliques:
QCM 3

QCM 3
Protéines motrices: kinésines / myosines
Myosines
(microfilaments)
Kinésines
(microtubules)
- Hydrolyse de l’ATP →changement conformationnel → mouvement
NB: Dynéine: famille différente
Domaine
moteur
(ATPase)
Domaine
moteur
(ATPase)
QCM 3
Tubuline et Microtubules
Transports intracellulaires: les protéines motrices
Protéines adaptatrices: 1 moteur peut transporter plusieurs « cargo » différents
Tige repliée (kinésine en conformation inactive)en absence de « cargo »
→évite les déplacements à vide
CARGO
•Kinésines et dynéines :
- 2 chaînes lourdes (têtes ATPasiques) + plusieurs chaînes légères (tige)
- Déplacement des vésicules, molécules et organites le long des MT
Cours de Biologie cellulaire, P. Cau, Ellipses
QCM 3
Tubuline et Microtubules
⊝
⊝⊝
⊝
KINESINES
DYNEINES
Microtubule ⊕
⊕⊕
⊕
vésicule
vésicule
Moteurs moléculaires des microtubules
Endocytose,
RE Golgi,
Mouvements des
cils, flagelles
Exocytose,
Membrane
plasmique
Golgi RE
QCM 3
(~ myosines)
Tubuline et Microtubules
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%