néocortex - Institut Curie

Biologie cellulaire de la neurogenèse de mammifères
UMR144 – Compartimentation et dynamique cellulaire
INSTITUT CURIE, 20 rue d’Ulm, 75248 Paris Cedex 05, France | 1
Alexandre Baffet
Chef d'équipe
alexandre.baff[email protected]
Tél : +33 1 56 24 63 60
Le néocortex est le centre des fonctions cognitives
supérieures comme la perception, la prise de décisions
ou encore le langage. Notre équipe étudie les
mécanismes impliqués dans le développement du
néocortex, et plus particulièrement le rôle et le
fonctionnement des cellules souches neurales.
Nous cherchons à comprendre comment la prolifération des cellules souches neurales est
contrôlée, tant dans l’espace que dans le temps, permettant ainsi l’organisation et la formation
du cortex cérébral. De plus, nous souhaitons définir comment des variations dans le
comportement de ces cellules souches peuvent influencer la forte expansion du cerveau
humain ; mais aussi caractériser leurs dysfonctionnements, susceptibles de conduire à des
malformations cérébrales.
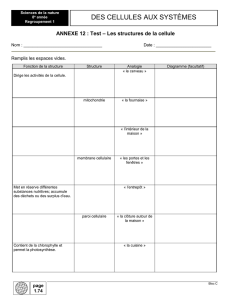
Pendant le développement, les cellules souches neurales, connu également sous le nom
de cellules apicales de la glie radiaire (aRG), donnent naissance directement ou indirectement à
tous les neurones néocorticaux, la plupart des cellules gliales et les cellules souches adultes. Les
cellules aRG ont une morphologie très allongée, avec deux prolongements cellulaires qui
s’étendent sur tout le cortex. Le premier dit basal, s’étend jusqu’à la surface piale du cerveau en
développement ; tandis que l’autre, apical, s’étend jusqu’à la surface ventriculaire (Fig. 1). Ces
cellules peuvent se diviser de façon symétrique pour s’auto-renouveler ; ou se diviser de façon
asymétrique pour produire une cellule aRG et un progéniteur intermédiaire. Ce dernier va se
diviser à son tour pour engendrer deux neurones. Ces neurones nouvellement formés vont
ensuite migrer vers la plaque corticale en s’appuyant le long des prolongements basaux des
cellules aRG. Ainsi les cellules aRG servent à la fois de cellules souches neuronales mais aussi
de pilier pour soutenir les neurones durant leur migration ; ce qui les place au centre même du
développement du néocortex.

Biologie cellulaire de la neurogenèse de mammifères
UMR144 – Compartimentation et dynamique cellulaire
INSTITUT CURIE, 20 rue d’Ulm, 75248 Paris Cedex 05, France | 2
Figure 1 : Développement du neocortex chez le mammifère
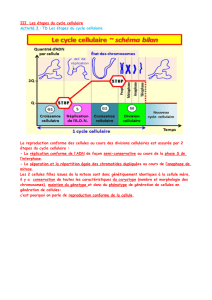
Les cellules aRG présentent un cycle cellulaire très particulier caractérisé par une oscillation du
noyau au cours du cycle, appelé « Interkinetic Nuclear Migration » (INM). Pendant la phase G1, le
noyau migre en position basale grâce au moteur microtubulaire Kif1A (extrémité positive). A
l’inverse pendant la phase G2, le noyau migre vers le pôle apical via cette fois-ci le moteur
Dynéine (extrémité négative du microtubule). Leurs noyaux, situés dans la zone ventriculaire
(ZV), migrent vers le pôle basal durant la phase G1 du cycle cellulaire puis vers le pôle apical
durant la phase G2. La division cellulaire des cellules aRG s’effectue toujours au niveau de la
surface ventriculaire. Lorsque la migration nucléaire est inhibée, les cellules ne parviennent pas
à entrer en mitose, entrainant ainsi des défauts de développement. Nous avons récemment
identifié le mécanisme de migration du noyau dit « Dynéine-dépendant » (position apicale),
impliqué pendant la phase G2 du cycle cellulaire. Ce mécanisme nécessite le recrutement de la
Dynéine via la protéine Cdk1 permettant ainsi de former un complexe au niveau des pores
nucléaires (Baffet et al., Dev. Cell, 2015; Hu*, Baffet*, Nayak* et al., Cell, 2013). L’INM n’est pas
un processus spécifique du cerveau en développement puisqu’elle se manifeste dans une
grande variété d’épithéliums. Cependant le rôle de ce phénomène dans le cerveau en
développement ou dans d’autres tissus reste jusqu’à ce jour inexpliqué.
Pour étudier le développement du néocortex, nous effectuons des électroporations in utero
couplées à de l’imagerie en temps réel sur des coupes de cerveaux embryonnaires (l’image 2). 1
à 4 jours après injection d’ADN et électroporation, les cerveaux embryonnaires sont disséqués,
coupés, puis placés sur un filtre en milieu de culture pour enfin être imagés en temps réel
pendant la nuit.
L’importante expansion du néocortex chez l’homme, résulte en partie par la présence d’un
deuxième type de population de cellules souches neurales, appelées les cellules basales de la
glie radiaire (cellules bRG, image 1). Les cellules bRG ne sont pas spécifiques au cerveau humain
mais leur abondance corrèle fortement avec le degré de circonvolution du cortex cérébral. En

Biologie cellulaire de la neurogenèse de mammifères
UMR144 – Compartimentation et dynamique cellulaire
INSTITUT CURIE, 20 rue d’Ulm, 75248 Paris Cedex 05, France | 3
effet, les cellules bRG sont rares dans le cerveau lissencéphalique de souris (caractérisé par un
cortex lisse) ; alors qu’elles sont au contraire très abondantes dans les cerveaux
gyrencéphaliques (cortex circonvolus) du macaque ou de l’Homme.
La gyrencéphalie permet de loger une surface beaucoup plus importante de tissu cortical dans le
volume limité d’une boîte crânienne. De ce fait, ces circonvolutions devraient jouer un rôle
majeur dans le développement des fonctions cognitives supérieures. En raison de l’extrême
rareté des cellules bRG chez la souris, les mécanismes contrôlant leur prolifération et leur auto-
renouvellement restent très méconnus.
Figure 2 : Electroporation in utero
Des perturbations survenant à différentes étapes du développement du néocortex, peuvent
conduire à des malformations corticales plus ou moins sévères. Ces pathologies sont associées à
une désorganisation des neurones ou à une réduction de la taille du cerveau ; et sont
caractérisées par une déficience intellectuelle ainsi que des cas d’épilepsies résistants aux
traitements. À ce jour, un grand nombre de ces malformations corticales restent inexpliquées :
d’une part parce que les mutations responsables sont encore à être identifiées et d’autre part
parce que la fonction de certains gènes identifiés reste mal caractérisée.
Publications clés
Année de publication : 2016
Jean-Baptiste Brault, Cécile Khou, Justine Basset, Laure Coquand, Vincent Fraisier, Marie-Pascale
Frenkiel, Bruno Goud, Jean-Claude Manuguerra, Nathalie Pardigon, Alexandre D Baffet (2016 Jul
26)

Biologie cellulaire de la neurogenèse de mammifères
UMR144 – Compartimentation et dynamique cellulaire
INSTITUT CURIE, 20 rue d’Ulm, 75248 Paris Cedex 05, France | 4
Comparative Analysis Between Flaviviruses Reveals Specific Neural Stem Cell
Tropism for Zika Virus in the Mouse Developing Neocortex.
EBioMedicine : DOI : S2352-3964(16)30323-1
Alexandre D Baffet, Aurélie Carabalona, Tiago J Dantas, David D Doobin, Daniel J Hu, Richard B
Vallee (2016 Jan 23)
Cellular and subcellular imaging of motor protein-based behavior in embryonic
rat brain.
Methods in cell biology : 349-63 : DOI : 10.1016/bs.mcb.2015.06.013
Année de publication : 2015
Alexandre D Baffet, Daniel J Hu, Richard B Vallee (2015 Jun 9)
Cdk1 Activates Pre-mitotic Nuclear Envelope Dynein Recruitment and Apical
Nuclear Migration in Neural Stem Cells.
Developmental cell : 703-16 : DOI : 10.1016/j.devcel.2015.04.022
Année de publication : 2014
Alexandre D Baffet (2014 Jan 30)
[Nuclear migration in neuronal progenitors: when the brain plays yo-yo].
Médecine sciences : M/S : 30-2 : DOI : 10.1051/medsci/20143001009
Année de publication : 2013
Daniel Jun-Kit Hu, Alexandre Dominique Baffet, Tania Nayak, Anna Akhmanova, Valérie Doye,
Richard Bert Vallee (2013 Sep 17)
Dynein recruitment to nuclear pores activates apical nuclear migration and
mitotic entry in brain progenitor cells.
Cell : 1300-13 : DOI : 10.1016/j.cell.2013.08.024
Année de publication : 2012
Alexandre D Baffet, Béatrice Benoit, Jens Januschke, Jennifer Audo, Vanessa Gourhand, Siegfried
Roth, Antoine Guichet (2012 Aug 3)
Drosophila tubulin-binding cofactor B is required for microtubule network
formation and for cell polarity.
Molecular biology of the cell : 3591-601 : DOI : 10.1091/mbc.E11-07-0633
1
/
4
100%