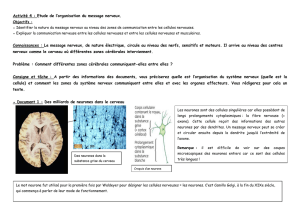
les neurones


LE TISSU NERVEUX
LES NEURONES
Le tissu nerveux se définit par la fonction de communication,
•du fait de sa propriété de percevoir,
•de conduire et
•de transmettre une excitation d'un point à un autre de l'organisme.
Organisé en un système (le système nerveux), ce tissu comporte
principalement des cellules nerveuses ou neurones,
des cellules gliales et
un compartiment extra-cellulaire.
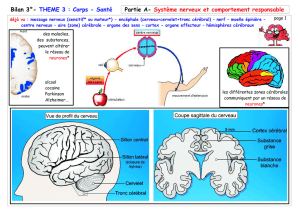
Le système nerveux se subdivise lui-même en
•système nerveux central (cerveau, cervelet, tronc cérébral et moelle
épinière) et
•système nerveux périphérique (nerfs, ganglions, terminaisons nerveuses).
•Le système nerveux central ou névraxe comporte des territoires de
substance grise et de substance blanche (du fait de la présence d'un
produit lipidique particulier, la myéline).

LES NEURONES
•Les cellules nerveuses nobles, ou neurones, sont les cellules du tissu nerveux
capables de transmettre des informations sous la forme de trains d'impulsion de
fréquence variable, correspondant à l'influx nerveux. Ces cellules s'articulent les
unes avec les autres pour constituer des chaînes de neurones, entrant en contact
avec les neurones suivants au niveau de synapses.
Chaque neurone possède un corps cellulaire ou péricaryon, ainsi que des
prolongements de deux types constituant les fibres nerveuses. La membrane
plasmique qui limite l'ensemble de ces éléments est responsable de la
transmission de l'influx nerveux. Les prolongements afférents ou dendrites,
habituellement multiples, conduisent l'influx vers le péricaryon tandis que le
prolongement efférent ou axone, toujours unique, conduit l'influx nerveux à
distance du péricaryon.

Le péricaryon
le neurone moteur multipolaire de la corne antérieure de la moelle, ou motoneurone
•de forme étoilée, représente le corps cellulaire avec le noyau et les organites
indispensables à la synthèse des protéines de structure et des neurotransmetteurs.
•Le noyau vésiculeux possède habituellement un à deux nucléoles. L'appareil de
Golgi est périnucléaire, les corps de Nissl correspondent à des mottes irrégulières
d'un matériel fortement basophile,
•dispersées dans tout le cytoplasme à l'exception de la région d'implantation de
l'axone. Fortement colorables au bleu de méthylène et riches en ARN, ils sont
constitués en microscopie électronique d'amas de citernes de reticulum granulaire
et de nombreux ribosomes libres.
•Les corps de Nissl témoignent de l'importance des synthèses protéiques du
neurone.

Le cytosquelette
comporte -des microfilaments d'actine, disséminés à la périphérie du péricaryon
-des neurofilaments, organisés en neurofibrilles. Ces neurofibrilles sont mises en
évidence par les techniques d'imprégnation à l'or ou à l'argent.
Il en existe classiquement deux réseaux : l'un périphérique fin de filaments
semblant provenir des dendrites; l'autre périnucléaire plus épais, semblant se
prolonger dans l'axone.
-des neurotubules, d'un diamètre de l'ordre de 24 nm, sont présents dans tout le
cytoplasme sans organisation particulière. Ils sont constitués de l'assemblage de
molécules de tubuline a et b.
- les mitochondries, nombreuses, sont réparties au hasard dans le cytoplasme.
-au cours du vieillissement, des grains de lipofuscine peuvent s'accumuler dans le
corps cellulaire et à la base des dendrites (mais pas dans l'axone).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
1
/
34
100%