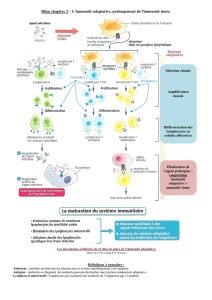
Mécanismes inflammatoires au cours des MICI

Mécanismes inflammatoires au
cours des MICI
CHU Rouen
DES Mars 2012

Plan
•Généralités
–Schéma général des MICI
–Microbiote intestinal
–Immunité innée/acquise
–Cytokines
–Autophagie
•Physiopathologie
–Dysbiose
– Anomalie de l’immunité innée
– Dysrégulation de l’immunité acquise
•Implications thérapeutiques et Conclusion

Généralités

Schéma général des MICI
Atteinte de l’immunité innée
Inflammation intestinale chronique
Lésions muqueuses et manifestations cliniques
Maladie
Multifactorielle
Environnement :
tabac, alimentation ...
Dysbiose Génétique
Atteinte de l’immunité acquise
(cytokines)

Microbiote intestinal
Interface entre monde extérieur et monde intérieur
Composée de 10^14 bactéries
3 Phylas (groupes) bactériens principaux
Firmicutes
75% Bacteroidetes
21 %
Actino-
bacteries
3%
Groupe des :
Clostridium
cocoïdes
Clostridium
Leptum dont
faecalibacterium
prausnitzii
...
Groupe des
Bactéroides
Bifidobactéries
et les bactéries
du groupe
Collinsella-
Atopobium
Variabilité inter-individuelle
Stabilité du microbiote intestinal au cours du temps
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
1
/
23
100%