Contexte Le gène LRRK-2

A Drosophila model for
LRRK2-linked parkinsonism
Zhaohui Liu, Xiaoyue Wang, Yi Yu, Xueping Li, Tao Wang, Haibing Jiang, Qiuting
Ren, Yuchen Jiao, Akira Sawa, Timothy Moran, Christopher A. Ross, Craig Montell
and Wanli W. Smith
Flore JEANDEAUD –Sébastian LEQUIME
D.P.R.B. Biotechnologies et Génie Génétique - Analyse d'article
Proceedings of the National Academy of Sciences (PNAS), 2008

Plan de l'analyse
1 - Contexte
2 - Question centrale et objectif
3 - Résultats
5 - Conclusion
Plan de l'exposé
- Maladie de Parkinson
- Gène LRRK-2
4 - Interprétation

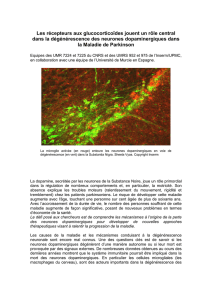
Contexte
- En France : 100 000 personnes et 8 000 nouveaux cas par an.
- Moteurs (posture, tremblements de repos, bradykinésie,...)
- Autres (sommeil, dépression, démence,...)
- Dégénérescence massive des neurones dopaminergiques nigro-striataux (plus de 70%)
- Présence des corps de Lewy (inclusions cytoplasmiques)
- Dégénérescences mineures d'autres groupes neuronaux
- Dans 5-10% des cas, héréditaire (10 loci chromosomiques identifiés)
- Dans environ 95% des cas, sporadique (cause inconnue, probablement multifactorielle)
Maladie de Parkinson
- 1,6% des personnes de plus de 65 ans.
Fréquence :
Symptômes :
Troubles cellulaires :
Étiologie :

Contexte
Le gène LRRK-2
- Leucine-rich repeat kinase
Rôle normal in vivo ?
- Une partie du gène LRRK-2 : synthèse d'un segment protéique riche en leucine
Note : les protéines à région riche en leucine jouent un rôle dans les
processus nécessitant des interactions protéine-protéine.
- Autres parties du gène : synthèse de deux domaines impliqués dans des
interactions protéine-protéine.
- Impliqué dans la synthèse d'une protéine, la dardarine (dardara : tremblement), une
enzyme à activité kinase, dont l'activité normale est inconnue.
Et en cas de mutation ?
- Mutations de ce gènes impliquées dans certaines formes héréditaires de la maladie de
Parkinson.

Question centrale et Objectif
Comment modéliser ces mutations ?
Établir un modèle utile pour :
- Étudier des pathologies associées au LRRK-2 (dont la maladie de Parkinson)
- Criblages thérapeutiques
Plusieurs questions se posent :
- Quel animal modèle choisir ?
- Le transgène s'exprime-t-il de façon adéquat ?
- Ses effets sont-ils quantifiables ?
- A-t-il un effet proche de celui observé chez l'humain ?
Les chercheurs ont ici choisi de travailler sur la drosophile
L'étude présentée dans cet article répond justement à ces dernières questions
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%