état final

OBSERVER
COULEURS ET IMAGES

Ch 5 : Changement de couleur et
réaction chimique
PARTIE 2: Avancement
d’une réaction chimique

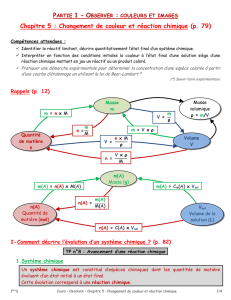
I) Description d’un système chimique
Lors d’une transformation chimique, la composition du système chimique
évolue d’un état initial à un état final.
L’état initial : instant où les espèces du système chimique sont mises en contact
L’état final : instant où la composition du système chimique n’évolue plus
Pour rappel, l’état d’un système chimique est décrit à un instant donné en
indiquant:
- la nature des espèces chimiques et leur état physique;
- la quantité de matière des différentes espèces
- la température et la pression

II) Proportions stoechiométriques
« Rien ne se perd, rien ne se crée, tout se transforme »
Antoine Lavoisier,
chimiste Français,
1743-1794
Rappel, une équation de réaction chimique s’écrit comme
ceci:
Réactifs Produits
On définit les « nombres stoechiométriques » comme
étant les proportions dans lesquelles les réactifs sont
consommés et les produits apparaissent
Si les réactifs sont consommés à l’état final, le mélange est dit stoechiométrique.
Exemple : Equilibrons les nombres stoechiométriques
1I2(aq) + 2S2O32- (aq) 2I-(aq) + 1S4O62- (aq)

III) Avancement de la réaction
Etat initial: x = 0 mol
Etat final: x = xmax
Définition : Avancement d’une réaction, noté x, exprimée en mol:
grandeur permettant de décrire l’évolution des quantités de matières d’un
système chimique au cours d’une transformation.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%