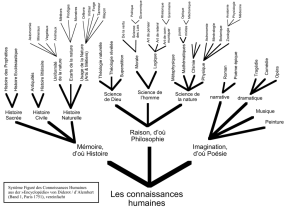
Document

Minéralogie-Pétrographie
Yves Géraud, 1 rue Blessig
Pvala Psiska, 1 rue Blessig
Hubert Whitechurch, 5 rue Descartes
EOST-IPGS
- introduction
- minéralogie des silicates
- classification des roches magmatiques
-classification des roches métamorphiques

Introduction :
Les silicates sont des minéraux dont la structure est
formée par de Si et O, ils composent les roches
magmatiques et métamorphiques.
Pourquoi s’intéresser à ces phases ?
1.- Si et O sont les principaux éléments de la croûte et
du manteau
2.- Les roches magmatiques et métamorphiques sont
deux étapes importantes du cycle des roches

Composition des enveloppes terrestres
Noyau interne
Fe
Ni
Fe
Ni
Co, S, Si, O
Noyau externe
O
Si
Mg Fe Ca
Al
Na, Cr, Ti, Mn, K, P
Manteau inférieur
O
Si
Mg Fe
Al
Ca, Na, Ti,C , Mn
Manteau supérieur
N, Ca, K, Si, Mg, S, Al, P, Cl H
C
O
Biosphère0
Si Al
Ca
MgFe
Croûte océanique
Na, K, Ti, Mn, H, C
O
Si
Al Fe
Ca
KNa
Mg, Ti, Mn, H, C
Croûte continentale

Le cycle des roches :
Un recyclage de la
matière

Le cycle des roches : un exemple géodynamique
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
1
/
36
100%