Immunologie de la transplantation et des greffes

DELAMARE Chloé G.Thibault
NORMAND Amélie Immunologie le 22/03/11
Immunologie de la transplantation et des greffes
I-Introduction
Les premières greffes et transplantations (années 40-50) nécessitaient une bonne
connaissance anatomique. Même si l’acte chirurgical était bien réalisé, il y avait quand même un
rejet du greffon. Ce rejet était lié à la réponse immunitaire. Le receveur rejette l’organe transplanté.
Aujourd’hui, on fait de la microchirurgie et on a compris la physiopathologie du rejet avec
le typage HLA : on sait reconnaître l'histocompatibilité entre le receveur et le donneur. De plus, le
problème du rejet est désormais maîtrisé grâce à l'arrivée des immunosuppresseurs (ciclosporine
dans les années 80),
Le problème en ce moment, c’est qu'il n'y a pas assez de greffons. Tous les 1er janvier,
l’Agence de Biomédecine donne le nombre de greffe par an. Le chiffre reste stable. En 2009, si on
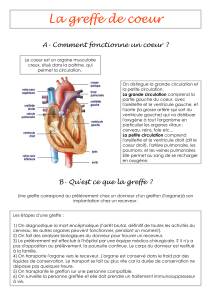
s’intéresse aux greffes d’organes 4428 ont été réalisées (greffes de rein : 2731 ; greffe de foie :
1037 ; greffe de cœur 358, 182 greffes de poumons, 90 greffes de pancréas, 22 greffes cœur-
poumons). Pour chacun des organes, les listes d’attente augmentent alors que le nombre de greffe
reste constant (2730 personnes greffés pour le rein et 7000 attendent une greffe).
Pourquoi le système immunitaire rejette -t-il l'organe d'un autre individu ?
On est dissemblable, d’où le rejet de greffe. C’est en raison de l’existence de polymorphisme au
sein de l’espèce humaine qu’il existe de l’histocompatibilité. Nous ne sommes pas identiques au
niveau moléculaire donc le système immunitaire détecte ces différences. On retrouve ce
polymorphisme au niveau :
•des groupes sanguins
•du complexe majeur d’histocompatibilité : énorme polymorphisme au niveau de ces
locus ce qui entraîne un polyallélisme. 2 individus apparentés ont peu de chance
d'avoir un CMH identique.
•Ag mineur d'histocompatibilité : avec le nombre d’allèles différents on augmente le
risque de rejet. Il en est de même pour le système du CMH. La notion de différence
au sein de l’espèce génère l’allogénicité. Le système immunitaire d’un individu X ne
supporte pas les cellules et les tissus d’un individu Y et va essayer de l’éliminer.
Pour limiter la réponse du système immunitaire, on met le patient en déficit immunitaire par
des médicaments. Le patient devient alors plus sensible aux infections, cancers, etc. On parle de
1

déficit immunitaire iatrogène.
Les différentes greffes possibles :
•La transplantation : greffe d’organe. On rétablit une circulation sanguine
(anastomose) entre l'organe greffé et le receveur.
•La greffe : concerne tout : organes, tissus, cellules (notamment les cellules souches
hématopoïétiques).
•Autogreffe : lorsque l'on prend tissu ou greffon chez le receveur pour lui regreffer
(ex : greffe de peau chez les grands brûlés ou de cellules souches hématopoïétiques
dans le cadre des hémopathies). Pas de rejet pour les autogreffes.
•Isogreffe : lorsqu'on greffe un greffon qui est identique au receveur sur le plan
génétique (des jumeaux venant d’un même œuf). Pas d'allogénicité dans cette
situation (pas de rejet).
•Allogreffe : situation standard et la plus fréquente. Le donneur et le receveur ne sont
pas génétiquement identiques. Mais on fait en sorte que le degré d’histocompatibilité
soit le meilleur possible.
Le donneur arrive souvent par accident, on établit alors sa carte HLA. Chaque personne susceptible
de recevoir une greffe doit être parfaitement identifiée. Logistique relativement lourde.
•Xénogreffe : greffe d’un organe d’une espèce à un receveur d’une autre espèce (ex :
du porc à l’homme). Rejet très important et non maîtrisé (problème de taille et
d’histocompatibilité).
•Les organes artificielles : quelques cœurs artificiels pendant des temps relativement
courts mais pour le moment ne remplacent pas la greffe de donneur vivant. Les
progrès en biomécanique vont permettre de remplacer les xénogreffes.
Le SI, pour rejeter un organe, agit pareil que pour éliminer une bactérie ou un organisme pathogène.
Le rejet se fait selon différentes phases :
- phase de sensibilisation : l'organisme reconnaît le greffon
- phase où les effecteurs sont générés
- phase de destruction du greffon (ex : nécrose de la peau greffée).
Expérience sur la souris :
On lui regreffe le même morceau de peau après un rejet. Elle ne va mettre que 6 jours à la rejeter
alors que la première fois elle avait mis 15 jours. On remarque donc qu’il y a une mémoire due aux
cellules spléniques. Elles transfèrent la capacité à rejeter le greffon car si on greffe le même greffon
sur une autre souris jamais transplantée, elle rejette également le greffon en 6 jours. Les cellules
2

spléniques responsables du rejet sont les LT CD4 et CD8. Le SI est le système clé du rejet.
Si on prend 2 souris : une AA et l’autre BB.
•Greffe d’une souris AA à une autre souris AA (idem avec BB) : pas de rejet de greffe
•Greffe de AA à AB (lignée F1): la greffe est acceptée car AB à le patrimoine génétique de A
•Greffe de BB à un individu AB : pas de rejet car AB a le patrimoine génétique de B
•Greffe de AB à un individu AA ou BB : rejet car AA n'a pas le patrimoine génétique B et
BB n'a pas le A.
=> De AA (ou BB) vers AB → histocompatibles
=> De AB vers AA (ou BB) → histoincompatibles
Ceci répond aux lois Mendéliennes mais n’est pas vrai pour les greffes des cellules
hématopoïétiques.
Les LT de receveur reconnaissent les Ag de l'organe du donneur. 2 hypothèses vis-à-vis de ce
mécanisme :
➢Présentation directe des Ag du donneur : les Ag du donneur sont présentés aux LT du
receveur par l'intermédiaire des molécules du CMH du donneur. Au niveau du thymus, tous
les LT qui ne reconnaissent pas les molécules du CMH du soi son éliminés. Pourtant dans ce
cas là les LT reconnaissent le CMH du donneur. On pense que les LT du receveur se
« trompent » et reconnaissent les molécules du CMH allogénique comme des cellules du soi.
➢Présentation indirecte : les molécules du CMH du donneur sont captées par les CpAg du
receveur. Les CpAg vont alors les découper et présenter un peptide à leur surface. Les
molécules du CMH sont traitées comme n'importe quel Ag.
Que la présentation soit directe ou indirecte, la réponse est identique : après reconnaissance
de l'Ag, prolifération des LT puis différenciation en effecteurs pour détruire le greffon. Tous les
éléments effecteurs du SI fonctionnent et les éléments du complément aussi. Pour maîtriser le rejet
il faut maîtriser la phase de reconnaissance. Les immunosuppresseurs chimiques essaient de
s'opposer à la génération d'effecteurs.
II- Aspects clinique
1. Transplantation d’organe
> Donneurs :
En France, les dons d’organes sont récupérés chez des personnes en état de mort encéphalique. L’an
dernier, 1481 donneurs dont 250 à 300 donneurs étaient vivants (ex : situation de greffe
intrafamiliale).
3

Le nombre de sujets recensés capables d’être donneurs est de 3081 (1481 ont été prélevé)→ dû au
refus de la part de la famille ou du sujet lui-même ou alors pour des raisons médicales (infections
virales, éthyliques,etc). Sur un même donneur, on va prélever plusieurs organes. Il faut toute une
organisation pour le prélèvement et la transplantation. Les donneurs sont le plus souvent les sujets
ayant subit un AVC ou alors un accident. Les organes doivent voyager pour trouver le receveur
potentiel. Le temps de survie d’un organe est relativement court (de l’ordre de qq heures), il faut
donc prendre en compte le temps de transport de l’organe et il faut que le receveur soit disponible à
tout moment pour une éventuelle greffe.
Au moment du prélèvement, on fait un typage HLA rapide ainsi qu'un prélèvement de sang qui
voyage avec l’organe sur lequel on fait des tests de compatibilité avec le receveur.
> Receveur :
Pénurie de greffons donc les receveurs sont sélectionnés selon l’urgence médicale et le degré de
compatibilité avec l’organe. Au niveau national, le registre de l'Agence de Biomédecine permet de
connaitre le receveur dont le degré d’urgence est le plus important.
On regarde si le receveur n’a pas d’Ac anti HLA qu'il peut développé si précédente greffe, si
transfusion ou si grossesse (la mère a des Ac contre le fœtus).
2. Forme du rejet
> Rejet suraigu : se passent dans les heures qui suivent la greffe, on a une nécrose de l’organe si le
sujet a des Ac anti HLA préexistants. Ces Ac sont fixés à la surface des cellules endothéliales du
greffon ce qui active la voie classique du complément (car immun-complexe), puis détruit le
greffon. La prévention est de savoir si le receveur possède des Ac anti HLA pour cela on fait un
cross-match (on prend les cellules du donneur que l'on met en présence du sérum du receveur et on
regarde si le sérum a une activité lytique). Les immunosuppresseurs ne fonctionnent pas dans ce cas
là.
> Rejet aigu : quand SI reconnaît Ag de l'organe et monte une réponse immunitaire classique
(prolifération, différenciation, effecteurs). Il faut qq jours avant que le réponse immunitaire se
mettent en place (1semaine à une 10aine de jours jusqu’à 6 mois après la transplantation). Le rejet
aigu peut être cellulaire (LT) ou humoral (Ac se fixent sur le greffon).Les immunosuppresseurs
agissent sur le rejet aigu cellulaire et humoral. La survie a fortement augmenté. On a cependant des
problèmes d’effets secondaires.
> Rejet chronique : dans les mois ou années qui suivent la transplantation. On a une altération des
vaisseaux qui irriguent le greffon (fibrose). Les immunosuppresseurs ne fonctionnent pas et ne
préviennent pas ce rejet.
Il n’est pas impossible que certaines personnes reçoivent plusieurs greffes. Les receveurs sont de
plus en plus âgés.
4

3. Greffe de cellules souches hématopoïétiques (CSH)
> Donneurs :
Le donneur est vivant. Il fait fréquemment parti de la famille du receveur (35 à 40% sont des greffes
intrafamiliale). On peut trouver des compatibilités très élevé en extrafamiliale car les donneurs sont
vivants. On peut soit :
➢prélever les CSH dans la moelle osseuse.
➢injecter des facteurs de croissance G-CSF chez le donneur pour que les cellules gagnent la
circulation pendant qq heures. On peut alors prélever les CSH directement dans le sang du
donneur.
➢prélever le sang placentaire qui contient un peu de CSH.
5
1
/
5
100%